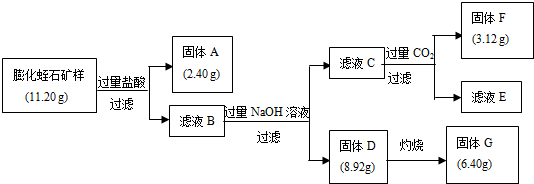
题目内容
3.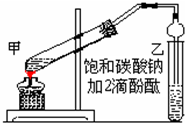 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下:①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min.
③待试管乙收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层、洗涤、干燥.
(1)配制该混合溶液的主要操作步骤为:先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加乙酸;
(2)反应中浓硫酸的作用是催化剂,吸水剂;
(3)写出制取乙酸乙酯的化学方程式:CH3COOH+CH3CH2OH ?浓硫酸△?浓硫酸△ CH3COOCH2CH3+H2O;
(4)上述实验中饱和碳酸钠溶液的作用是(填字母):BC.
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(5)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有分液漏斗;分离时,乙酸乙酯应该从仪器上口倒(填:“下口放”或“上口倒”)出.
分析 (1)浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;
(2)浓硫酸起到催化作用和吸水剂的作用;
(3)乙酸与乙醇在浓硫酸作用下加热反应生成乙酸乙酯和水;
(4)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(5)乙酸乙酯不溶于碳酸钠溶液,可以通过分液操作分离,必须使用的仪器为分液漏斗;乙酸乙酯的密度较小,在混合液上层,所以乙酸乙酯从分液漏斗的上口倒出.
解答 解:(1)浓硫酸密度大于水,且溶于水放出大量热,应该将浓硫酸加入乙醇中,正确操作方法为:将浓H2SO4加入乙醇中,边加边振荡,然后再加入乙酸或先将乙醇与乙酸混合好后再加浓硫酸并在加入过程中不断振荡;
故答案为:先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加乙酸;
(2)浓硫酸在酯化反应中起到了催化剂、吸水剂的作用,故答案为:催化剂,吸水剂;
(3)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应为:CH3COOH+CH3CH2OH ?浓硫酸△?浓硫酸△ CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH ?浓硫酸△?浓硫酸△ CH3COOCH2CH3+H2O;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,所以BC正确,
故答案为:BC;
(5)乙酸乙酯不溶于碳酸钠溶液,所以混合液会分层,可以通过分液操作分离出乙酸乙酯,使用到的主要仪器为分液漏斗;乙酸乙酯密度小于碳酸钠溶液,分液时从分液漏斗的上口倒出,
故答案为:分液漏斗;上口倒.
点评 本题考查了乙酸乙酯的制取方法,难度中等,注意掌握乙酸乙酯的制备方法及反应原理,明确浓硫酸、饱和碳酸钠溶液在实验中的作用.

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案 ,其余为-Cl,则-Cl的数目可能是( )
,其余为-Cl,则-Cl的数目可能是( )| A. | 2n+3a-m | B. | a+2-m | C. | n+m+a | D. | a+2n+2-m |
| A. | 甲烷的结构式: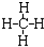 | B. | 丙烯的结构简式CH3CHCH2 | ||
| C. | 葡萄糖分子式:C6H12O6 | D. | 甲烷分子球棍模型: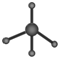 |
| A. | CH4和C2H4 | B. | CH4和C2H6 | C. | C2H4和C2H6 | D. | C3H4和C3H6 |
| A. | 制备乙炔:实验室不能用启普发生器来制取乙炔 | |
| B. | 制备乙酸乙酯:将乙醇和乙酸混合,再加入稀硫酸共热 | |
| C. | 制备一氯乙烷:将乙烷和氯气的混合气放在光照条件下反应 | |
| D. | 制备乙烯:实验室用无水乙醇和浓硫酸共热到170℃制取乙烯 |
| A. | 22.4LCO2与11.2LCO气体所含的分子数 | |
| B. | 放热反应中,反应物的总能量与生成物的总能量 | |
| C. | 0.2mol/LNaOH与0.1mol/LNa2CO3溶液中Na+的物质的量浓度 | |
| D. | 1mol水分子与1mol铵根离子中含有的电子数 |
| A. | 常温下金属A一定能与水反应,B一定不能与水反应 | |
| B. | A与B用导线连接后放入酒精中,一定形成原电池 | |
| C. | A与B用导线连接后放入B(NO3)2的溶液中,一定有电流产生 | |
| D. | 由A与B形成的原电池,A一定是负极,B一定是正极 |
| A. | 0.1mol Na2O2固体中阳离子与阴离子的总数为0.4NA | |
| B. | 46g NO2和N2O4的混合气体中含有的氧原子数为2NA | |
| C. | 1mol Fe与硫恰好完全反应时,转移电子数一定为3NA | |
| D. | 标准状况下,1mol CH4与过量的氯气发生取代反应,生成CH3Cl气体的体积约为22.4L |