题目内容
13.蛭石为一种层状结构的含镁的铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,因为其受热膨胀时呈挠曲状,形态酷似水蛭,故此得名蛭石.膨化后的蛭石呈颗粒状,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸.(1)某硅酸盐矿石的组成可以看作SiO2中有1/4的Si被Al置换,再由Mg平衡其电荷形成的.该矿石的组成以氧化物形式表示为MgO•Al2O3•6SiO2.
(2)某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示.为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
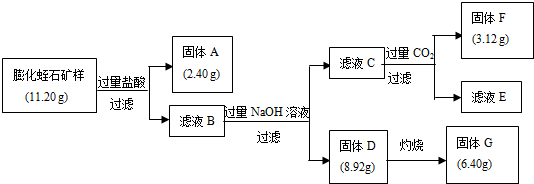
①固体A的化学式是SiO2;
②固体F的物质的量是0.040mol;
③通过计算,给出用氧化物的形式表示某种膨化蛭石组成的化学式4MgO•Al2O3•Fe2O3•2SiO2•H2O.
分析 (1)设某含Si的盐矿石的组成可以看作其氧化物中有$\frac{1}{4}$的Si被Al替换,再由Mg平衡其电荷形成的,
二氧化硅中硅的化合价是+4价,铝在化合物中是+3价,镁在化合物中是+2价,二氧化硅的化学式为SiO2,有$\frac{1}{4}$的Si被铝原子取代,设镁原子个数是x,根据化合价的代数和为0得,$\frac{3}{4}$×4+$\frac{1}{4}$×3+2x=2×2,x=$\frac{1}{4}$,则该化学式中硅、铝、镁、氧原子个数之比=$\frac{3}{4}$:$\frac{1}{4}$:$\frac{1}{8}$:2=6:2:1:16,;
(2)膨化蛭石与盐酸反应生成氯化镁、氯化铁、氯化铝和没有反应的二氧化硅以及多余的盐酸,然后过滤,滤液中含有镁离子、铁离子和铝离子,向滤液中加入氢氧化钠得到氢氧化铁、氢氧化镁沉淀,和偏铝酸钠溶液,然后分析解题.
解答 解:(1)设某含Si的盐矿石的组成可以看作其氧化物中有$\frac{1}{4}$的Si被Al替换,再由Mg平衡其电荷形成的,
二氧化硅中硅的化合价是+4价,铝在化合物中是+3价,镁在化合物中是+2价,二氧化硅的化学式为SiO2,有$\frac{1}{4}$的Si被铝原子取代,设镁原子个数是x,根据化合价的代数和为0得,$\frac{3}{4}$×4+$\frac{1}{4}$×3+2x=2×2,x=$\frac{1}{4}$,则该化学式中硅、铝、镁、氧原子个数之比=$\frac{3}{4}$:$\frac{1}{4}$:$\frac{1}{8}$:2=6:2:1:16,所以其化学式为MgO.Al2O3.6SiO2,
故答案为:MgO.Al2O3.6SiO2;
(2)①膨化蛭石与盐酸反应生成氯化镁、氯化铁、氯化铝和没有反应的二氧化硅以及多余的盐酸,
故答案为:SiO2;
②固体F是氢氧化铝,n=$\frac{m}{M}$=$\frac{3.12g}{78g/mol}$=0.04mol,故答案为:0.04mol;
③设固体G中氧化铁的物质量为xmol,氧化镁为ymol,则由题意可知:
160x+40y=6.4
214x+58y=8.92
解之得:x=0.02mol,y=0.08mol,
而二氧化硅的物质的量为$\frac{2.40g}{60g/mol}$=0.04mol,所以水的物质量为=$\frac{11.2-2.4-6.4-\frac{0.04}{2}×102}{18}$=0.02mol,
则n(MgO):n(Fe2O3):n(Al2O3):n(SiO2):n(H2O)=0.08:0.02:0.02:0.04:0.02=4:1:1:2:1即组成为:4MgO•Al2O3•Fe2O3•2SiO2•H2O,
故答案为:4MgO•Al2O3•Fe2O3•2SiO2•H2O.
点评 本题考查Mg、Al、Fe、Si等元素化合物知识与物质的分离提纯的应用、物质的量计算等知识点,难度中等,理解工艺流程图是解题关键,是对知识的综合运用与对学生能力考查.

| A. | 钢和铁 | B. | 金刚石和石墨 | C. | 红磷和白磷 | D. | 氧气和臭氧 |
| A. | KOH的电子式: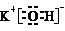 | |
| B. | S2-的离子结构示意图: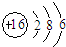 | |
| C. | 乙炔的分子式:C2H4 | |
| D. | 质子数为6、中子数为8的碳原子:${\;}_{6}^{8}$C |
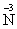 .
.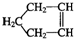 可简写为
可简写为 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: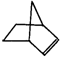
 .
.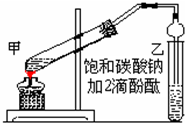 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: