题目内容
2.氢气是未来理想的能源,用MnFe2O4热化学循环制氢气的原理如下(x不为零):MnFe2O4→MnFe2O4-x(s)+$\frac{x}{2}$O2(g)△H1;MnFe2O4-x(s)+xH2O(g)═MnFe2O4(s)+xH2(g)△H2,下面说法正确的是( )| A. | 上述两个反应都是氧化还原反应,且转移电子数相等 | |
| B. | Mn与Fe都属于ⅤⅡ族元素 | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-2(△H1+△H2) | |
| D. | 根据两个反应可以看出,非自发反应加入合适的催化剂可以自发进行 |
分析 A.可根据O、H元素化合价的变化判断;
B.Mn属于ⅦB族,Fe属于Ⅷ族元素;
C.依据盖斯定律结合热化学方程式计算分析所得到的热化学方程式正误;
D.催化剂只改变反应速率.
解答 解:A.MnFe2O4→MnFe2O4-x(s)+$\frac{x}{2}$O2(g)中,O元素化合价由-2价升高到0价转移2x电子,MnFe2O4-x(s)+xH2O(g)═MnFe2O4(s)+xH2(g)中H元素化合价由+1价降低到0价,转移2x电子,故A正确;
B.Mn属于ⅦB族,Fe属于Ⅷ族元素,故B错误;
C.①MnFe2O4(s)=MnFe2O(4-x)(s)+$\frac{x}{2}$O2(g);△H1 ②MnFe2O(4-x)(s)+xH2O(g)=MnFe2O4(s)+xH2(g);△H2
由热化学方程式结合盖斯定律,①+②得到xH2O(g)=xH2(g)+$\frac{x}{2}$O2 (g);△H=△H1+△H2,xH2(g)+$\frac{x}{2}$O2 (g)=xH2O(g)△H3=-(△H1+△H2),则2H2(g)+O2(g)=2H2O(g)△H=-$\frac{x}{2}$(△H1+△H2),故C错误;
D.催化剂只改变反应速率,不能决定反应能否进行,故D错误.
故选A.
点评 本题考查较为综合,涉及化学反应能量变化分析判断,盖斯定律计算应用,元素守恒的计算等知识,为高频考点,侧重于学生的分析、计算能力的考查,题目难度较大.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
12.下列关于化学用语表示正确的是( )
| A. | 四氯化碳电子式: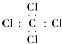 | |
| B. | 质子数35、中子数45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子结构示意图: | |
| D. | HClO的结构式:H-Cl-O |
13.(1)为了达到下表中的实验要求,请从“供选择的化学试剂及方法”栏中,选择正确选项的字母代号填入对应的空格中.
(2)A的结构简式如下:A分子中两种含氧官能团的名称是羟基、羧基.

请写出该物质与足量的金属钠发生反应的化学方程式 +4Na→
+4Na→ +2H2↑.
+2H2↑.
| 序号 | 实验要求 | 答案 | 供选择的化学试剂及方法 |
| a | 检验乙酸是否具有酸性 | A.新制的氢氧化铜悬浊液 | |
| b | 检验植物油中是否含有碳碳双键 | B.紫色石蕊试液 | |
| c | 检验尿液中是否含有葡萄糖 | C.加入饱和Na2CO3溶液,分液 | |
| d | 除去乙酸乙酯中的少量乙酸 | D.溴水 |

请写出该物质与足量的金属钠发生反应的化学方程式
 +4Na→
+4Na→ +2H2↑.
+2H2↑.
17.下列有机化合物中,刚开始滴入NaOH溶液会出现分层现象,用水浴加热后分层现象逐渐消失的是( )
| A. | 乙酸 | B. | 乙酸乙酯 | C. | 苯 | D. | 汽油 |
13.下列对一些实验事实和理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 稀硫酸能导电 | H2SO4为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
14.下列措施不合理的是( )
| A. | 将煤粉碎,增大固体的表面积可以有效加快煤燃烧的速率 | |
| B. | 空气过量有利于煤充分燃烧,因此鼓入空气的量越多约好 | |
| C. | 可以用在煤中加入生石灰,减少SO2气体的排放 | |
| D. | 煤的气化可以使煤发生化学反应转化为水煤气等 |
 酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出,该气体点燃后可燃烧.
酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出,该气体点燃后可燃烧.