题目内容
1.下列参数比较及解释均正确的是( )| 选项 | 参数 | 比较 | 解释 |
| A | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| B | 半径 | Na+<Mg2+<Al3+ | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 还原性 | P3->S2->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢化物都属于分子晶体,分子晶体的熔沸点与相对分子质量成正比,但含有氢键的熔沸点较高;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素的非金属性越强,其简单阴离子的还原性越弱.
解答 解:A.氢化物都属于分子晶体,分子晶体的熔沸点与相对分子质量成正比,但含有氢键的熔沸点较高,这几种氢化物中HF中含有氢键,熔沸点最高,所以熔沸点高低为HCl<HI<HF,故A错误;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径Na+>Mg2+>Al3+,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,亚硫酸不是S元素的最高价氧化物的水化物,所以不能根据酸性强弱判断非金属性强弱,故C错误;
D.元素的非金属性越强,其简单阴离子的还原性越弱,非金属性Cl>S>P,所以离子的还原性P3->S2->Cl-,故D正确;
故选D.
点评 本题考查氢化物熔沸点高低判断、离子半径半径、非金属性强弱与酸及简单阴离子还原性的关系,侧重考查学生分析判断能力,明确元素周期律及物质性质即可解答,注意A中氢键对物质熔沸点的影响,易错选项是C,注意只有元素最高价氧化物的水化物才能比较非金属性强弱,题目难度不大.

练习册系列答案
相关题目
12.下列关于化学用语表示正确的是( )
| A. | 四氯化碳电子式: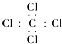 | |
| B. | 质子数35、中子数45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子结构示意图: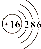 | |
| D. | HClO的结构式:H-Cl-O |
9.X、Y两种有机物的分子式不同,但均含有C、H或C、H、O,将X、Y以任意比例混合 只要物质的量之和不变,完全燃烧时所消耗的氧气量和生成水的物质的量也分别不变,则下列有关判断正确的是:( )
| A. | X、Y分子式中氢原子数不一定要相同,碳原子数必定不同 | |
| B. | 若X为CH4,则相对分子质量最小的Y是甲醇 | |
| C. | 若X为CH4,则相对分子质量最小的Y是乙二醇 | |
| D. | X、Y的化学式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数) |
6.表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)9种元素中,化学性质最不活泼的是Ne,还原性最强的单质是Na.(用元素符号表示).
(2)③与⑧分别与氢形成的化合物沸点较高的是H2O(用化学式表示).
(3)请写出①与②元素形成的最简单的有机物的电子式:
(4)④与⑨两种元素非金属性强弱顺序为:⑨<④(填“>”或“<”或“=”)
(5)⑥、⑦、⑧、⑨四种元素形成的简单离子中,离子半径最大的是S2-(用元素符号表示).
(6)⑦与⑥的最高价氧化物对应的水化物反应的化学反方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(2)③与⑧分别与氢形成的化合物沸点较高的是H2O(用化学式表示).
(3)请写出①与②元素形成的最简单的有机物的电子式:

(4)④与⑨两种元素非金属性强弱顺序为:⑨<④(填“>”或“<”或“=”)
(5)⑥、⑦、⑧、⑨四种元素形成的简单离子中,离子半径最大的是S2-(用元素符号表示).
(6)⑦与⑥的最高价氧化物对应的水化物反应的化学反方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
13.(1)为了达到下表中的实验要求,请从“供选择的化学试剂及方法”栏中,选择正确选项的字母代号填入对应的空格中.
(2)A的结构简式如下:A分子中两种含氧官能团的名称是羟基、羧基.
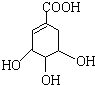
请写出该物质与足量的金属钠发生反应的化学方程式 +4Na→
+4Na→ +2H2↑.
+2H2↑.
| 序号 | 实验要求 | 答案 | 供选择的化学试剂及方法 |
| a | 检验乙酸是否具有酸性 | A.新制的氢氧化铜悬浊液 | |
| b | 检验植物油中是否含有碳碳双键 | B.紫色石蕊试液 | |
| c | 检验尿液中是否含有葡萄糖 | C.加入饱和Na2CO3溶液,分液 | |
| d | 除去乙酸乙酯中的少量乙酸 | D.溴水 |

请写出该物质与足量的金属钠发生反应的化学方程式
 +4Na→
+4Na→ +2H2↑.
+2H2↑.
13.下列对一些实验事实和理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 稀硫酸能导电 | H2SO4为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |

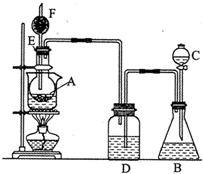 酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出,该气体点燃后可燃烧.
酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出,该气体点燃后可燃烧.