题目内容
【题目】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:

(1)1mol焦炭在过程Ⅰ中失去____mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为________。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为_________。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_________。
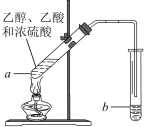
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是_________。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
A.还原过程需在无氧的气氛中进行 |
B.投入1molZn可生成14g还原产物 |
C.增加SiCl4(g)的量,该反应平衡常数不变 |
D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=_______(两位有效数字)。
【答案】2 2Cl-+ 2H2O![]() Cl2↑ + H2↑ + 2OH- CH3OH一6e-+8OH- =CO32-+7H2O SiCl4+2H2O=SiO2+4HCl 使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量 AC 3.2×10-5
Cl2↑ + H2↑ + 2OH- CH3OH一6e-+8OH- =CO32-+7H2O SiCl4+2H2O=SiO2+4HCl 使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量 AC 3.2×10-5
【解析】
石英砂的主要成分是二氧化硅,用焦炭在高温下还原得到粗硅,和氯气反应生成液体SiCl4,分离出SiCl4后用锌在高温下还原得到高纯硅。
(1)焦炭与二氧化硅反应生成Si和CO,C元素的化合价升高2价,所以1mol焦炭参加反应,转移电子的物质的量是2mol;
(2)电解饱和食盐水生成氯气、氢气、氢氧化钠、离子方程式是2Cl-+ 2H2O![]() Cl2↑ + H2↑ + 2OH-;
Cl2↑ + H2↑ + 2OH-;
(3)若用甲醇燃料电池作电源,用KOH作电解质,则甲醇在负极发生氧化反应,因为电解质溶液为碱性,所以生成的二氧化碳与氢氧根离子反应生成碳酸根离子和水,则负极反应方程式是CH3OH一6e-+8OH- =CO32-+7H2O;
(4)①SiCl4遇水剧烈水解生成SiO2和一种酸,根据元素守恒,该酸为HCl,所以水解方程式是SiCl4+2H2O=SiO2+4HCl ;
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,将约90℃的潮湿氯气先冷却至12℃,使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,因为浓硫酸与水混合会放出大量的热,从操作安全着想,该操作还能降低放出的热量,降低安全隐患;
(5)A.Zn为活泼金属,易与空气中的氧气反应,所以还原过程需在无氧的气氛中进行 ,正确;B.该反应是可逆反应,投入1molZn不可能完全转化为生成物,所以生成还原产物的质量小于14g ,错误; C.温度不变,则平衡常数不变,所以增加SiCl4(g)的量,该反应平衡常数不变,正确; D.一个固定反应的反应热是固定值,不随反应物的用量而改变,错误,答案选AC;
(6)已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,则100g水中Ag2SO4的物质的量是0.624g/312g/mol=0.002mol,溶有0.002mol Ag2SO4的100g水的体积近似为0.1L,根据饱和溶液中存在Ag2SO4![]() 2Ag++SO42-,则硫酸根离子的浓度是0.002mol/0.1L=0.02mol/L,银离子的浓度是0.04mol/L,所以该温度下Ag2SO4的Ksp= 0.02×0.042=3.2×10-5。
2Ag++SO42-,则硫酸根离子的浓度是0.002mol/0.1L=0.02mol/L,银离子的浓度是0.04mol/L,所以该温度下Ag2SO4的Ksp= 0.02×0.042=3.2×10-5。

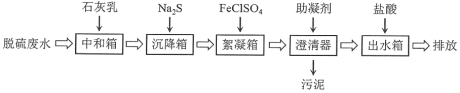
【题目】工业生产中常用炼锌废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来提取氧化锌和金属铜等,其主要工艺流程如图所示:

有关氢氧化物开始沉淀和沉淀完全的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 5.4 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 | 6.7 | 8.0 |
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条) ______
(2)试剂A是 ______ (填化学式).
(3)调节酸浸液的pH的范围是 ______.
(4)滤液甲与试剂B发生置换反应,则试剂B是 ______ (填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是 ______ .