题目内容
【题目】某氯化铁(FeCl3)样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行,根据流程回答以下问题:
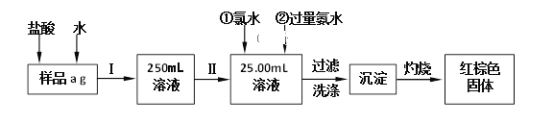
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_______、_______。
(2)写出加入氯水发生的离子反应方程式________________________________。
(3)写出加入过量氨水发生的离子反应方程式_______________________________。
(4)写出灼烧发生反应的化学方程式_______________________________。
(5)检验沉淀是否已经洗涤干净的操作是______________________________。
(6)下列操作可能使所配溶液浓度偏小的是__________(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(7)若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是_____________。
【答案】250mL容量瓶 胶头滴管。 2Fe2++Cl2==2Fe3++2Cl— Fe3++3NH3H2O= Fe(OH)3↓+3NH4+ 2Fe(OH)3![]() Fe2O3+3H2O 取最后一次洗涤液少许,加入硝酸酸化的硝酸银溶液,若产生白色沉淀则没有洗涤干净;若没有产生白色沉淀则洗涤干净。 ①④ 42%
Fe2O3+3H2O 取最后一次洗涤液少许,加入硝酸酸化的硝酸银溶液,若产生白色沉淀则没有洗涤干净;若没有产生白色沉淀则洗涤干净。 ①④ 42%
【解析】
本实验目的是测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数;
(1) 根据配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;
(2) 根据Cl2具有氧化性,能氧化Fe2+;
(3)加入过量氨水的目的是将溶液中的Fe3+完全转化为Fe(OH)3沉淀;
(4) Fe(OH)3受热分解生成Fe2O3和水;
(5) 取最后一次洗涤液少许,加入硝酸酸化的硝酸银溶液,若产生白色沉淀则没有洗涤干净;若没有产生白色沉淀则洗涤干净;
(6) 依据溶液配制过程和实验步骤分析判断选项中,根据c=![]() =
=![]() 来分析各操作对浓度的影响;
来分析各操作对浓度的影响;
(7) 加热分解所得的物质是Fe2O3,其质量为0.6g,由于取的25mL溶液,故250mL溶液可以得到Fe2O3质量为6g,根据化学式计算铁元素的质量,再利用质量分数的定义计算原氧化铁样品中铁元素的质量分数。
实验目的为测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数;
(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,配制250mL溶液时还缺少250mL容量瓶和胶头滴管;
(2)因Cl2具有氧化性,能氧化Fe2+,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(3)加入过量氨水的目的是将溶液中的Fe3+完全转化为Fe(OH)3沉淀,发生的离子反应方程式Fe3++3NH3H2O= Fe(OH)3↓+3NH4+;
(4)灼烧是Fe(OH)3分解生成Fe2O3和水,发生反应的化学方程式为2Fe(OH)3![]() Fe2O3+3H2O;
Fe2O3+3H2O;
(5) 最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,可证明洗涤干净,
(6) 依据溶液配制过程和实验步骤分析判断选项,根据c=![]() =
=![]() 来
来
①未洗涤烧杯和玻璃棒,溶质未全部转移到容量瓶,使得m减少,浓度偏低,故①正确;
②定容时俯视容量瓶的刻度线,容量瓶中水未加到刻度线,使得V偏小,浓度偏大,故②错误;
③配溶液前容量瓶中有少量蒸馏水对配制溶液浓度无影响,故③错误;
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切,使得V偏大,溶液浓度偏小,故④正确;
故答案为:①④;
(7) 加热分解所得的物质是Fe2O3,其质量为0.6g,由于取的25mL溶液,故250mL溶液可以得到Fe2O3质量为6g,依据铁元素守恒计算铁元素的质量分数= 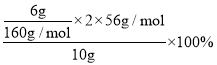 =42%。
=42%。

【题目】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
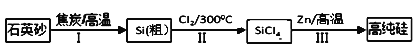
(1)1mol焦炭在过程Ⅰ中失去____mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为________。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为_________。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_________。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是_________。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
A.还原过程需在无氧的气氛中进行 |
B.投入1molZn可生成14g还原产物 |
C.增加SiCl4(g)的量,该反应平衡常数不变 |
D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=_______(两位有效数字)。