题目内容
【题目】某学习小组对SO2使溶液褪色的机理进行探究。
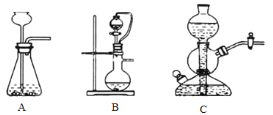
I.SO2气体的制备和性质初探
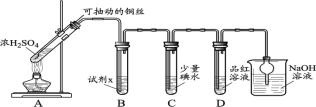
(1)装置A中发生反应的化学方程式____________。
(2)装置B中的试剂x是____________。
(3)小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,得出C中溶液褪色的原因是____________。
II.小组同学通过实验继续对D中品红溶液褪色进行探究。
(4)探究使品红褪色的主要主要微粒(分别取2 mL试剂a,滴加2滴品红溶液)
装置 | 序号 | 试剂a | 实验现象 |
| i | 0.1 mol/L SO2溶液(pH=2) | 红色逐渐变浅,之后完全褪色 |
ii | 0.1 mol/L NaHSO3溶液(pH=5 ) | 红色立即变浅,之后完全褪色 | |
iii | 0.1 mol/L Na2SO3溶液( pH=10) | 红色立即褪色 | |
iv | pH=2H2SO4溶液 | 红色无明显变化 | |
v | 试剂a | 红色无明显变化 |
①实验 iii中Na2SO3溶液显碱性的原因_____________(结合化学用语分析解释)。
②对比实验iii 和v,可以排除在该实验条件下OH-对品红褪色的影响,则试剂a可能
是__________溶液。
查阅资料:品红与SO2水溶液、NaHSO3溶液、Na2SO3溶液反应前后物质如下:
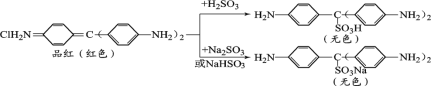
③通过上述实验探究并结合资料,小组同学得出结论:一是使品红溶液褪色的主要微粒是________;二是品红溶液中颜色变化主要与其分子中的________结构有关。
(5)验证SO2使品红褪色反应的可逆性
①甲同学加热实验i褪色后的溶液,产生刺激性气味气体,红色恢复,从化学平衡移动角度解释红色恢复的原因__________。
②乙同学向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,生成白色沉淀,溶液变红。写出生成白色沉淀的离子方程式___________。
③丙同学利用SO2的还原性,运用本题所用试剂,设计了如下实验,证实了SO2使品红褪色反应的可逆:则试剂Y是__________。

【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑ +2H2O 饱和NaHSO3溶液 SO2具有还原性,与I2发生氧化还原反应,SO2+I2+2H2O=H2SO4+2HI,使碘水的黄色褪去。 SO32-在溶液发生水解,SO32-+ H2O
CuSO4+SO2↑ +2H2O 饱和NaHSO3溶液 SO2具有还原性,与I2发生氧化还原反应,SO2+I2+2H2O=H2SO4+2HI,使碘水的黄色褪去。 SO32-在溶液发生水解,SO32-+ H2O![]() HSO3-+OH-,SO32-结合H2O电离的H+,最终达到平衡时溶液中c(OH-)>c(H+),溶液呈碱性。 pH=10的NaOH溶液或pH=10的Na2CO3溶液 H2SO3、SO32-、HSO3- 双键或共轭或对醌式结构 SO2+H2O
HSO3-+OH-,SO32-结合H2O电离的H+,最终达到平衡时溶液中c(OH-)>c(H+),溶液呈碱性。 pH=10的NaOH溶液或pH=10的Na2CO3溶液 H2SO3、SO32-、HSO3- 双键或共轭或对醌式结构 SO2+H2O![]() H2SO3,加热使溶液中SO2逸出,溶液中H2SO3和SO2浓度均降低,使SO2与品红反应逆向移动,最终达到平衡时,溶液中品红浓度增大,溶液恢复红色。 SO2+2OH-+Ba2+=BaSO3↓+H2O 碘水
H2SO3,加热使溶液中SO2逸出,溶液中H2SO3和SO2浓度均降低,使SO2与品红反应逆向移动,最终达到平衡时,溶液中品红浓度增大,溶液恢复红色。 SO2+2OH-+Ba2+=BaSO3↓+H2O 碘水
【解析】
I.Cu与浓硫酸混合加热发生反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑ +2H2O,制取得到的SO2气体,经B装置中NaHSO3饱和溶液的缓冲作用,SO2具有还原性,在C中SO2与碘水会发生氧化还原反应:SO2+I2+2H2O=H2SO4+2HI;SO2具有漂白性,将其通入D中的品红溶液,看到溶液红色褪去,SO2是大气污染物,通入NaOH溶液,发生反应:SO2+2NaOH=Na2SO3+H2O进行尾气处理。
CuSO4+SO2↑ +2H2O,制取得到的SO2气体,经B装置中NaHSO3饱和溶液的缓冲作用,SO2具有还原性,在C中SO2与碘水会发生氧化还原反应:SO2+I2+2H2O=H2SO4+2HI;SO2具有漂白性,将其通入D中的品红溶液,看到溶液红色褪去,SO2是大气污染物,通入NaOH溶液,发生反应:SO2+2NaOH=Na2SO3+H2O进行尾气处理。
Ⅱ.(4)①利用盐的水解规律分析溶液显碱性的原因;
②选用溶液pH=10的NaOH或Na2CO3溶液进行对比;
③根据使品红溶液褪色的物质分析使品红溶液褪色的微粒;
(5)①加热实验i褪色后的溶液,产生刺激性气味气体,该气体为SO2,同时看到溶液红色恢复;
②SO2与Ba(OH)2发生反应产生BaSO3沉淀,同时看到溶液变红色;
③根据反应SO2+I2+2H2O=H2SO4+2HI分析SO2使品红褪色反应的可逆性。
(1)在装置A中Cu与浓硫酸共热,发生氧化还原反应,产生CuSO4、SO2、H2O,发生反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑ +2H2O;
CuSO4+SO2↑ +2H2O;
(2)B装置中溶液可以缓冲气流,同时不能溶解SO2气体,可根据H2SO3是二元弱酸,在溶液中存在电离平衡,则B中x溶液为饱和NaHSO3溶液;
(3)小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,这是由于I2具有氧化性,而SO2具有还原性,在溶液中二者会发生氧化还原反应:SO2+I2+2H2O=H2SO4+2HI,反应产生的H2SO4、HI的水溶液均无色,使C中溶液褪色;
(4)①Na2SO3是强碱弱酸盐,在溶液中SO32-会发生水解反应:SO32-+H2O![]() HSO3-+OH-,SO32-结合H2O电离的H+,当最终达到平衡时,溶液中c(OH-)>c(H+),因此溶液呈碱性;
HSO3-+OH-,SO32-结合H2O电离的H+,当最终达到平衡时,溶液中c(OH-)>c(H+),因此溶液呈碱性;
②对比实验iii和v,可以排除在该实验条件下OH-对品红褪色的影响,验iii为pH=10的Na2SO3溶液,则试剂a可能为pH=10的NaOH溶液或pH=10的Na2CO3溶液;
③根据实验可知,向红色的品红溶液中加入Na2SO3、NaHSO3,会看到溶液红色褪去,说明使品红溶液褪色的主要微粒是H2SO3、SO32-、HSO3-;根据反应前后溶液颜色变化,结合物质分子结构可知:品红溶液中颜色变化主要与其分子中的双键或共轭或对醌式结构有关;
(5)①向品红溶液中通入SO2气体,溶液红色褪去,将褪色后的溶液加热,产生刺激性气味气体,红色恢复,说明SO2气体溶于水发生反应:SO2+H2O![]() H2SO3,加热时溶液中SO2气体逸出,溶液中H2SO3和SO2浓度均降低,使SO2与品红反应逆向移动,品红浓度增大,溶液又恢复红色;
H2SO3,加热时溶液中SO2气体逸出,溶液中H2SO3和SO2浓度均降低,使SO2与品红反应逆向移动,品红浓度增大,溶液又恢复红色;
②向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,发生反应:SO2+2OH-+Ba2+=BaSO3↓+H2O,生成白色沉淀,由于SO2浓度降低,SO2与品红反应逆向移动,品红浓度增大,使溶液又恢复了变红;
③由于SO2具有还原性,与碘水会发生氧化还原反应:SO2+I2+2H2O=H2SO4+2HI,使溶液中SO2浓度降低,SO2与品红反应逆向移动,导致品红浓度增大,最终使溶液又恢复了变红。