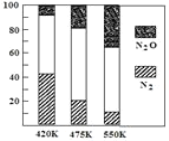
题目内容
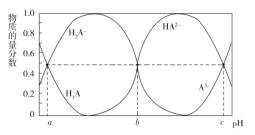
【题目】室温下,乙二胺(H2NCH2CH2NH2,用符号B表示)溶于水存在如下平衡:B + H2OHB+ + OH-Kb1;HB+ + H2OH2B2+ + OH-Kb2。其水溶液中的相关组分B、HB+、H2B2+的物质的量分数δ(X)随溶液pH的变化曲线如图所示[δ(X)=![]() ]。下列说法正确的是
]。下列说法正确的是
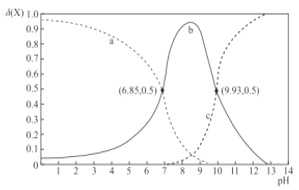
A.曲线b表示δ(H2B2+)随溶液pH的变化情况
B.等浓度的乙二胺的水溶液与盐酸等体积混合后,溶液呈酸性
C.等物质的量的[H2B]Cl2和[HB]Cl的混合溶液中,c(H2B2+)<c(HB+)
D.Kb1的数量级为10-4
【答案】C
【解析】
由图可知,曲线a在强酸性条件下含量最高,说明该曲线是H2B2+的物质的量分数随溶液pH的变化曲线;曲线b在强酸性或强碱性条件下含量极低,说明该曲线是HB+的物质的量分数随溶液pH的变化曲线;则曲线c表示B的物质的量分数随溶液pH的变化曲线;由a、b曲线交点可以计算Kb2=![]() =10-7.15,由b、c曲线交点可以计算Kb1=
=10-7.15,由b、c曲线交点可以计算Kb1=![]() =10-4.07,据此分析。
=10-4.07,据此分析。
A.由上述分析,曲线b是HB+的物质的量分数随溶液pH的变化曲线,A错误;
B.由图可知,Kb1=10-4.07,Kb2=10-7.15,等浓度的乙二胺的水溶液与盐酸等体积混合后所得溶液中的溶质为[HB]Cl,Kh(HB+)=![]() =10-9.93,则HB+的电离程度大于其水解程度,溶液呈碱性,B错误;
=10-9.93,则HB+的电离程度大于其水解程度,溶液呈碱性,B错误;
C.等物质的量的[H2B]Cl2和[HB]Cl的混合溶液中,Kh(H2B2+)=![]() =10-6.85>Kb2,则混合溶液中c(H2B2+)<c(HB+),C正确;
=10-6.85>Kb2,则混合溶液中c(H2B2+)<c(HB+),C正确;
D.由分析可知Kb1=10-4.07,则Kb1的数量级为10-5,D错误;
故选C。

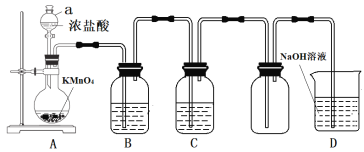
【题目】某学习小组对SO2使溶液褪色的机理进行探究。
I.SO2气体的制备和性质初探
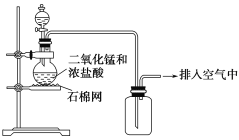
(1)装置A中发生反应的化学方程式____________。
(2)装置B中的试剂x是____________。
(3)小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,得出C中溶液褪色的原因是____________。
II.小组同学通过实验继续对D中品红溶液褪色进行探究。
(4)探究使品红褪色的主要主要微粒(分别取2 mL试剂a,滴加2滴品红溶液)
装置 | 序号 | 试剂a | 实验现象 |
| i | 0.1 mol/L SO2溶液(pH=2) | 红色逐渐变浅,之后完全褪色 |
ii | 0.1 mol/L NaHSO3溶液(pH=5 ) | 红色立即变浅,之后完全褪色 | |
iii | 0.1 mol/L Na2SO3溶液( pH=10) | 红色立即褪色 | |
iv | pH=2H2SO4溶液 | 红色无明显变化 | |
v | 试剂a | 红色无明显变化 |
①实验 iii中Na2SO3溶液显碱性的原因_____________(结合化学用语分析解释)。
②对比实验iii 和v,可以排除在该实验条件下OH-对品红褪色的影响,则试剂a可能
是__________溶液。
查阅资料:品红与SO2水溶液、NaHSO3溶液、Na2SO3溶液反应前后物质如下:
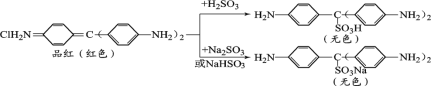
③通过上述实验探究并结合资料,小组同学得出结论:一是使品红溶液褪色的主要微粒是________;二是品红溶液中颜色变化主要与其分子中的________结构有关。
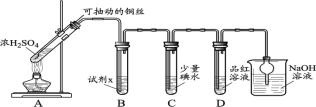
(5)验证SO2使品红褪色反应的可逆性
①甲同学加热实验i褪色后的溶液,产生刺激性气味气体,红色恢复,从化学平衡移动角度解释红色恢复的原因__________。
②乙同学向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,生成白色沉淀,溶液变红。写出生成白色沉淀的离子方程式___________。
③丙同学利用SO2的还原性,运用本题所用试剂,设计了如下实验,证实了SO2使品红褪色反应的可逆:则试剂Y是__________。