题目内容
【题目】在托盘天平两盘上分别放有盛有等质量的足量稀盐酸的烧杯,调整天平至平衡。向左边烧杯中加入10.8 g镁条,向右边烧杯中加入10.8 g铝条(两金属外形相同,表面均经过砂纸打磨处理)。反应过程中指针偏转情况正确的是( )
A.先偏左,最后偏右B.先偏右,最后偏左
C.先偏左,最后平衡D.先偏右,最后平衡
【答案】B
【解析】
金属与酸反应时,溶液的质量增加,增加的质量为m(金属)-m(氢气),金属质量相同时,反应生成的氢气质量越大,溶液增加的质量越小。开始时,镁的金属性强于铝,镁与酸反应的速度快,产生的氢气多,则指针偏向溶液质量大的,即加入铝的右盘;足量的稀盐酸中金属完全反应,10.8 g镁条完全反应生成氢气的质量为![]() ×2mol/L=0.9g,铝完全反应生成氢气的质量为
×2mol/L=0.9g,铝完全反应生成氢气的质量为![]() ×2g/mol=1.2g,加入铝的右盘产生氢气多,则指针最后偏向于溶液质量大的,即加入镁的左盘,故B正确。
×2g/mol=1.2g,加入铝的右盘产生氢气多,则指针最后偏向于溶液质量大的,即加入镁的左盘,故B正确。

练习册系列答案
相关题目
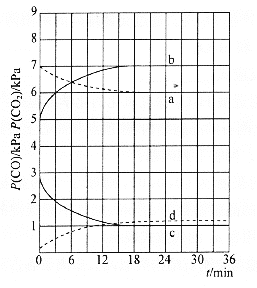
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
容器 | 温度/℃ | 起始物质的量浓度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
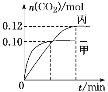
反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时υ(正)<υ(逆)