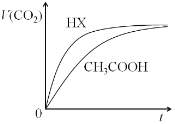
题目内容
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
【答案】0.04mol·L-1·s-1 1.5 mol·L-1 0.4 mol·L-1 1∶1 不变 不变 减小 增大 不变
【解析】
3A(g)+B(g)2C(g)+2D(g)
起始(mol): a b 0 0
转化(mol): 1.2 0.4 0.8 0.8
平衡(mol): 1.8 0.6 0.8 0.8
(1) 10s内v(C)=![]() ;
;
(2)反应前,n(A)= 1.8mol+1.2mol=3mol,c(A)=![]() ;
;
(3)10 s末,c(D)=![]() ;
;
(4) 开始时n(A)=(1.8+1.2)mol=3.0mol,开始时n(B)=(0.4+0.6)mol=1.0mol,加入的反应物物质的量之比等于其计量数之比时,反应物的转化率相等;
(5) 反应前后气体计量数之和不变,则反应前后气体总物质的量不变,反应前后气体总质量不变,根据![]() =
=![]() 可知其平均摩尔质量不变,摩尔质量在数值上等于其相对分子质量,反应前后气体总质量不变、容器体积不变;
可知其平均摩尔质量不变,摩尔质量在数值上等于其相对分子质量,反应前后气体总质量不变、容器体积不变;
(6) ①降低温度,反应速率减小;
②增大A的浓度,反应速率增增大;
③恒容下冲入Ne,对参加反应的气体来说,浓度不变,则速率不变;
3A(g)+B(g)2C(g)+2D(g)
起始(mol): a b 0 0
转化(mol): 1.2 0.4 0.8 0.8
平衡(mol): 1.8 0.6 0.8 0.8
(1)v(C)=![]() =0.04mol·L-1·s-1,
=0.04mol·L-1·s-1,
故答案为:0.04mol·L-1·s-1;
(2)反应前,c(A)=![]() =1.5 mol·L-1,
=1.5 mol·L-1,
故答案为:1.5 mol·L-1;
(3)10 s末,c(D)=![]() =0.4 mol·L-1,
=0.4 mol·L-1,
故答案为:0.4 mol·L-1;
(4) 开始时n(A)=(1.8+1.2)mol=3.0mol,开始时n(B)=(0.4+0.6)mol=1.0mol,加入的反应物物质的量之比等于其计量数之比时,反应物的转化率相等,加入的A.B的物质的量之比等于其计量数之比,则A.B的转化率相等,故α(A)=α(B),则α(A):α(B) =1:1,
故答案为:1:1;
(5) 反应前后气体计量数之和不变,则反应前后气体总物质的量不变,反应前后气体总质量不变,根据![]() =
=![]() 可知其平均摩尔质量不变,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量不变;反应前后气体总质量不变、容器体积不变,则密度不变,
可知其平均摩尔质量不变,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量不变;反应前后气体总质量不变、容器体积不变,则密度不变,
故答案为:不变;不变;
(6) 由反应3A(g)+B(g)2C(g)+2D(g)可知:
①降低温度,反应速率减小,
故答案为:减小;
②增大A的浓度,反应速率增大,
故答案为:增大;
③恒容下充入Ne,对参加反应的气体来说,浓度不变,则速率不变,
故答案为:不变。

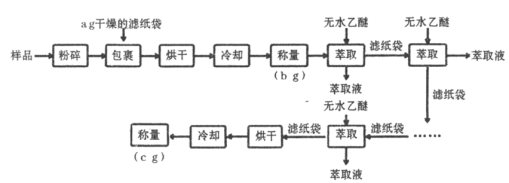
【题目】谷物中脂肪含量虽少,但却是其品质优劣的指标之一。黄玉米中粗脂肪(以亚油酸甘油酯为主)含量测定的实验流程如下:
已知:亚油酸甘油酯沸点![]() ;乙醚熔点
;乙醚熔点![]() ,沸点
,沸点![]() ,易燃。
,易燃。
回答下列问题:
(1)实验中两次“冷却”均在干燥器中进行,其目的是____________________。
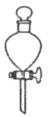
(2)上述实验中多次“萃取”均在下列____________仪器中进行(填字母标号)。
|
|
|
a | b | c |
(3)为了克服多次萃取实验操作繁琐,萃取剂消耗量过大的缺点, Franz von Soxhlet发明了索氏抽提筒。若将上述实验的多次萃取改为在下图装置中进行(约需10~12h):
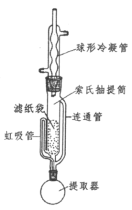
①为提高乙醚蒸气的冷凝效果,球形冷凝管可改用_____________(填仪器名称)。实验中常在冷凝管上口连接一个装有活性炭的球形干燥管,其目的是_______________。
②实验中需控制提取器(烧瓶)温度在60℃~70℃之间,应采取的加热方式是_____________________。
③索氏提取法原理:当无水乙醚加热沸腾后,蒸气通过____________(填字母标号,下同)上升,被冷凝为液体滴入抽提筒中,当液面超过________________________最高处时,萃取液即回流入提取器(烧瓶)中……如此往复。
a.冷凝管 b.虹吸管 c.连通管
④索氏提取法存在的明显缺点是__________________。
(4)数据处理:样品中纯脂肪百分含量_______________(填“<”、“>”或“=”)![]() ,原因是_______________________。
,原因是_______________________。