题目内容
【题目】化学反应速率和限度与生产、生活密切相关。
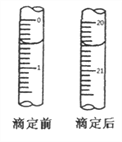
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
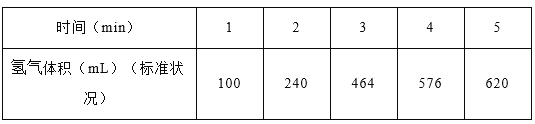
①哪一时间段反应速率最大______min(填0~1、1~2、2~3、3~4、4~5),原因是_____。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率_________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是____。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
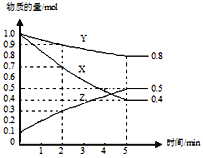
①该反应的化学方程式是_______。
②该反应达到平衡状态的标志是______
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1mol Y的同时消耗2mol Z
③2min内Y的转化率为______。
【答案】 2~3 因该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快 0.025 mol/(Lmin) CD 3X(g)+Y(g)![]() 2Z(g) AC 10%
2Z(g) AC 10%
【解析】(1)①在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为100mL、140mL、224mL、112mL、54mL,由此可知反应速率最大的时间段为2~3 min;原因是:因该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快;②在3~4min时间段内,n(H2)=0.112L/22.4L·mol-1=0.005mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.01mol,则υ(HCl)=0.01mol/(0.4L·1min)=0.025mol/(L·min);③A.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,故A正确;B.加入KCl溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;C.加入KNO3溶液,H+浓度减小,因酸性溶液中有NO3-,具有强氧化性,与Zn反应无氢气生成,故C错误;D.加入CuSO4溶液,Zn置换出Cu,形成原电池,反应速度增大,且影响生成氢气的量,故D错误;故选CD;(3)①由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到5min时,△n(Y)=0.2mol,△n(Z)=0.4mol,△n(X)=0.6mol,则△n(Y):△n(Z):△n(X)=1:2:3,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:3X(g)+Y(g)![]() 2Z(g);②A.体积固定,混合气体的总物质的量不确定,Y的体积分数在混合气体中保持不变,反应达到平衡状态,故A正确;B.X、Y的反应速率比为3∶1,随着反应的进行X、Y的反应速率比始终为3:1,不能作为平衡状态的标志,故B错误;C.体积固定,混合气体的总物质的量不确定,当容器的压强保持一定,说明正逆反应速率相等,达平衡状态,故C正确;D.反应物生成物均为气体,容器内气体的总质量保持不变,不能作为平衡状态的标志,故D错误;E.生成1mol Y的同时消耗2mol Z 均只能表示逆速率,不能说明正逆反应速率相等,无法判断反应达到平衡状态,故E错误;故选AC。③2min内X的转化率为=变化物质的量/起始总物质的量 ×100%=(1mol-0.9mol)/1mol ×100%=10%.
2Z(g);②A.体积固定,混合气体的总物质的量不确定,Y的体积分数在混合气体中保持不变,反应达到平衡状态,故A正确;B.X、Y的反应速率比为3∶1,随着反应的进行X、Y的反应速率比始终为3:1,不能作为平衡状态的标志,故B错误;C.体积固定,混合气体的总物质的量不确定,当容器的压强保持一定,说明正逆反应速率相等,达平衡状态,故C正确;D.反应物生成物均为气体,容器内气体的总质量保持不变,不能作为平衡状态的标志,故D错误;E.生成1mol Y的同时消耗2mol Z 均只能表示逆速率,不能说明正逆反应速率相等,无法判断反应达到平衡状态,故E错误;故选AC。③2min内X的转化率为=变化物质的量/起始总物质的量 ×100%=(1mol-0.9mol)/1mol ×100%=10%.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案【题目】某学习小组对SO2使溶液褪色的机理进行探究。
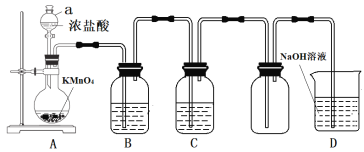
I.SO2气体的制备和性质初探
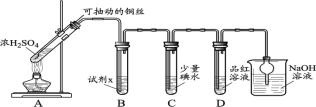
(1)装置A中发生反应的化学方程式____________。
(2)装置B中的试剂x是____________。
(3)小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,得出C中溶液褪色的原因是____________。
II.小组同学通过实验继续对D中品红溶液褪色进行探究。
(4)探究使品红褪色的主要主要微粒(分别取2 mL试剂a,滴加2滴品红溶液)
装置 | 序号 | 试剂a | 实验现象 |
| i | 0.1 mol/L SO2溶液(pH=2) | 红色逐渐变浅,之后完全褪色 |
ii | 0.1 mol/L NaHSO3溶液(pH=5 ) | 红色立即变浅,之后完全褪色 | |
iii | 0.1 mol/L Na2SO3溶液( pH=10) | 红色立即褪色 | |
iv | pH=2H2SO4溶液 | 红色无明显变化 | |
v | 试剂a | 红色无明显变化 |
①实验 iii中Na2SO3溶液显碱性的原因_____________(结合化学用语分析解释)。
②对比实验iii 和v,可以排除在该实验条件下OH-对品红褪色的影响,则试剂a可能
是__________溶液。
查阅资料:品红与SO2水溶液、NaHSO3溶液、Na2SO3溶液反应前后物质如下:
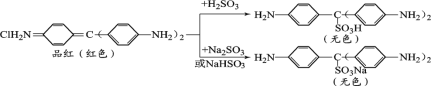
③通过上述实验探究并结合资料,小组同学得出结论:一是使品红溶液褪色的主要微粒是________;二是品红溶液中颜色变化主要与其分子中的________结构有关。
(5)验证SO2使品红褪色反应的可逆性
①甲同学加热实验i褪色后的溶液,产生刺激性气味气体,红色恢复,从化学平衡移动角度解释红色恢复的原因__________。
②乙同学向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,生成白色沉淀,溶液变红。写出生成白色沉淀的离子方程式___________。
③丙同学利用SO2的还原性,运用本题所用试剂,设计了如下实验,证实了SO2使品红褪色反应的可逆:则试剂Y是__________。