题目内容
【题目】R、W、X、Y、M是原子序数依次增大的五种短周期主族元素。R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2。工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与 X 是同一主族的元素,且在元素周期表中与X相邻。
(1)W的原子结构示意图是_______________。
(2)WX2的电子式是________________。
(3)R2X、R2Y中,稳定性较高的是___________(填化学式),请从原子结构的角度解释其原因:_____________________。
(4)Se与Y是同一主族的元素,且在元素周期表中与Y相邻。
①根据元素周期律,下列推断正确的是___________填字母序号)。
a.Se的最高正化合价为+7价
b.H2Se的还原性比H2Y强
c.H2SeO3的酸性比H2YO4强
d.SeO2在一定条件下可与NaOH溶液反应
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为_______。
【答案】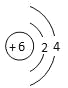
![]() H2O O与S为同主族元素,O的电子层数小于S,O的原子半径小于S,O的原子核对核外电子吸引能力大于S原子,O的非金属性强于S,故H2O的稳定性大于 H2S。 bd 3SeO2+ 4NH3=3Se + 2N2+ 6H2O
H2O O与S为同主族元素,O的电子层数小于S,O的原子半径小于S,O的原子核对核外电子吸引能力大于S原子,O的非金属性强于S,故H2O的稳定性大于 H2S。 bd 3SeO2+ 4NH3=3Se + 2N2+ 6H2O
【解析】
R、W、X、Y、M是原子序数依次增大的五种短周期主族元素。R最常见同位素的原子核中不含中子,R为H元素;W与X可形成两种稳定的化合物:WX和WX2,工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高,则W为C元素、X为O元素;Y与X是同一主族的元素,且在元素周期表中与X相邻,Y为S元素;M的原子序数最大,M为Cl元素,据此分析解答。
由上述分析可知,R、W、X、Y、M五种短周期主族元素分别为H、C、O、S、Cl。
(1)C的原子结构示意图是![]() ,故答案为:
,故答案为:![]() ;
;
(2)WX2为CO2,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)R2X、R2Y分别为H2O和H2S,O与S为同主族元素,O的电子层数小于S,O的原子半径小于S,O的原子核对核外电子吸引能力大于S原子,O的非金属性强于S,故H2O的稳定性大于H2S,稳定性较高的是H2O,故答案为:H2O;O与S为同主族元素,O的电子层数小于S,O的原子半径小于S,O的原子核对核外电子吸引能力大于S原子,O的非金属性强于S,故H2O的稳定性大于H2S;
(4)①a.Se的最外层电子数为6,最高正化合价为+6价,故a错误;b.非金属性S大于Se,则H2Se的还原性比H2S强,故b正确;c.H2SeO3为弱酸,H2SO4为强酸,故c错误;d.SeO2为酸性氧化物,一定条件下可与NaOH溶液反应生成盐和水,故d正确;故答案为:bd;
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为3SeO2+4NH3═3Se+2N2+6H2O,故答案为:3SeO2+4NH3═3Se+2N2+6H2O。

 阅读快车系列答案
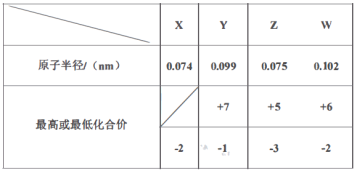
阅读快车系列答案【题目】X、Y、Z、W为四种常见元素,其中X、Y、Z为短周期元素。有关信息如表所示.
原子或分子相关信息 | 单质或化合物相关信息 | |
X |
| X的最高价氧化物对应的水化物为无机酸中的最强酸 |
Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
Z | Z原子的最外层电子数是次外层电子数的 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
W | W原子的最外层电子数小于4 | W的常见化合价有 |
(1)W在周期表中的位置为______,![]() 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
(2)X的简单阴离子的结构示意图为______,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为________
(3)Z的氧化物在通讯领域用来作______,工业上制备Z的单质的化学反应方程式为______。锗与Z是同一主族元素,它可用来制造半导体品体管.研究表明:有机锗具有明显的抗肿瘤活性,锗不与![]() 溶液反应但在有
溶液反应但在有![]() 存在时可与
存在时可与![]() 溶液反应生成锗酸盐,反应的化学方程式为_______
溶液反应生成锗酸盐,反应的化学方程式为_______