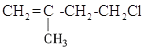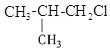题目内容
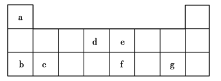
【题目】X、Y、Z、W、M、R、Q是短周期主族元素,部分元素的原子半径和化合价信息如下表所示:
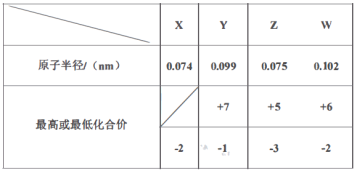
M的焰色反应为黄色:X、Y、R位于周期表中不同周期;Q的单质为半导体材料。
(1)Q元素在周期表中的位置是___;构成化合物M2X2的化学键类型是___。
(2)写出X、Y、R按原子个数之比为1:1:1形成的化合物的电子式___。
(3)Y与W相比,非金属性较强的是___(用元素符号表示),下列事实能证明这一结论的是___(选填字母序号)。
a.常温下W的单质呈固态,Y的单质呈气态
b.Y与W形成的化合物中W呈正价
c.Y和M反应时,lmolY原子所得电子数少于lmolW原子所得电子数
(4)R、W两种元素组成的离子在水溶液中与H+和OH-都不能大量共存,还能与氯水反应,写出其与新制氯水反应的离子方程式___。
(5)Z2R4为二元弱碱,在水中的电离与氨相似,写出其在水中的第一步电离方程式___,Z2R4与磷酸形成的磷酸二氢盐的化学式为___。
【答案】第一周期第ⅠA族 离子键、共价键 ![]() Cl b 4Cl2+4H2O+HS-=9H++SO42-+8Cl- N2H4+H2O
Cl b 4Cl2+4H2O+HS-=9H++SO42-+8Cl- N2H4+H2O![]() N2H5++OH- N2H6(H2PO4)2
N2H5++OH- N2H6(H2PO4)2
【解析】
从表格中可知,X的化合价为-2,X为O,Y的最高化合价为+7、最低化合价为-1,Y为Cl,W的最高化合价为+6、最低化合价为-2,W为S,Z的最高化合价为+5、最低化合价为-3,Z为N或P,且半径小于Y和W,所以Z为N,M的焰色反应为黄色,M为Na,X、Y、R位于周期表中不同周期,R为H,Q的单质为半导体材料,Q为Si。
(1)Q为H,在周期表中的位置是第一周期第ⅠA族;M为Na、X为O,构成化合物M2X2的化学式为Na2O2,化学键类型为离子键、共价键;
(2)X为O、Y为Cl、R为H,X、Y、R按原子个数之比为1:1:1形成的化合物为HClO,其电子式 ![]() ;
;
(3)Y为Cl、W为S,Y与W相比,非金属性较强的Cl;
a. 状态不能作为判断非金属性强弱的依据,a错误;
b. Cl与S形成的化合物中S呈正价,说明Cl吸引电子的能力强,Cl元素的非金属性更强,b正确;
c. 得电子数目与非金属性强弱无必然的联系,c错误;
(4)R为H、W为S,R、W两种元素组成的离子为HS-,在水溶液中与H+和OH-都反应,所以不能大量共存,能与氯水反应,其与新制氯水反应的离子方程式为:4Cl2+4H2O+HS-=9H++SO42-+8Cl-;
(5)Z为N、R为H,Z2R4为N2H4,二元弱碱,在水中的电离与氨相似,其在水中的第一步电离方程式为:N2H4+H2O![]() N2H5++OH-,N2H4与磷酸形成的磷酸二氢盐的化学式为N2H6(H2PO4)2
N2H5++OH-,N2H4与磷酸形成的磷酸二氢盐的化学式为N2H6(H2PO4)2

 53随堂测系列答案
53随堂测系列答案