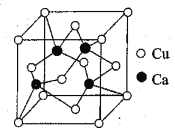
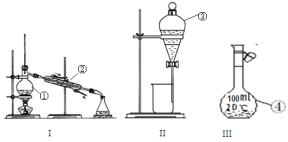
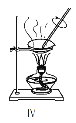
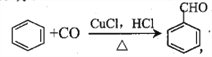��Ŀ����
����Ŀ����Ȼ���н�������֮�����ԭ��ط�Ӧ����ͼ��ʾװ���е缫��Ϊ��Ǧ��(PbS)���缫��Ϊ���з�Ǧ����������е������Һ����ͼ��ʾ����������װ��ʱ��������ָ��ƫת�����缫���������ϼ��٣�a����Һ�м���KSCN��Һδ���ֺ�ɫ������CuSO4��Һδ���ֺ�ɫ�����������й�˵������ȷ����( )
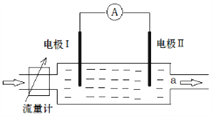
A����ҵ�����ø�ԭ��������
B���缫��������
C����Һ������װ�ú�pH����
D����װ�ø����ĵ缫��ӦΪFeS2��15e��+8H2O=Fe3++2SO42��+16H+
���𰸡�A
��������
����������缫���������ϼ��٣�˵���缫��Ϊ������a����Һ�м���KSCN��Һδ���ֺ�ɫ��˵����Һ�в�����Fe3+������CuSO4��Һδ���ֺ�ɫ������˵����Һ�в�����S2-���������ܽ�����Fe2+��SO42-��A�����ݷ�����ͨ����װ�ã��������ܽ�����Fe2+���������ø�ԭ������������A��ȷ��B�����������������缫������������B����C����װ�ø����ĵ缫��ӦΪFeS2��14e��+8H2O=Fe2++2SO42��+16H+����Һ������װ�ú�pH��С����C����D�����ݷ�������Һ�в�����Fe3+����D����ѡA��

��ϰ��ϵ�д�
 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�
�����Ŀ