题目内容
【题目】CuCl广泛应用于有机合成催化。例如 回答下列问题:
回答下列问题:
(1)CuCl中Cu+核外电子排布式为______________,Cu与Cl相比,第一电离能较大的是______________。
(2)已知![]() 为平面分子,则-CHO中碳原子的杂化方式为______________。
为平面分子,则-CHO中碳原子的杂化方式为______________。
(3)写出与CO互为等电子体的非极性分子的电子式______________,14gCO中含______________molπ键。合成氨工业中用铜洗液吸收CO,形成配合物[Cu(NH3)3CO]Ac(HAc代表醋酸),其中______________ (填粒子符号)接受孤对电子形成配位键,配位数是______________。
(4)铜钙可形成合金,单质铜的熔点比单质钙高,其原因是____________________________,其中一种合金的晶胞结构构如图所示,已知:该晶体的密度为ρg·cm-3,NA是阿伏加德罗常数的值,则其中两个Ca原子核之间距离为______________。

【答案】 [Ar]3d10 Cl sp2 ![]() 1 Cu+ 4 铜晶体中的金属键比钙晶体中的金属键强度大(合理即可)
1 Cu+ 4 铜晶体中的金属键比钙晶体中的金属键强度大(合理即可) ![]()
【解析】(1)考查电子排布式的书写、第一电离能规律,Cu位于第四周期IB,核外电子排布式为 [Ar]3d10;Cl属于非金属,Cu属于金属,因此Cl的第一电离能大于Cu;(2)考查杂化类型判断,醛基中C有3个σ键,无孤电子对,因此杂化类型为sp2;(3)考查等电子体、化学键、配位键,根据等电子体的定义,符合条件的是N2,即N2的电子式为![]() ;C与O之间共用叁键,1molCO中含有2molπ键,因此14gCO含有π键物质的量为14×2/28mol=1mol,根据配合物组成,Cu+为接受孤对电子,配位数为4;(4)考查晶体熔沸点高低判断、晶胞的计算,金属晶体熔沸点高低判断,需要比较金属键强弱,金属键越强,熔沸点越高,因此有铜晶体中的金属键比钙晶体中的金属键强度大;晶胞的质量为
;C与O之间共用叁键,1molCO中含有2molπ键,因此14gCO含有π键物质的量为14×2/28mol=1mol,根据配合物组成,Cu+为接受孤对电子,配位数为4;(4)考查晶体熔沸点高低判断、晶胞的计算,金属晶体熔沸点高低判断,需要比较金属键强弱,金属键越强,熔沸点越高,因此有铜晶体中的金属键比钙晶体中的金属键强度大;晶胞的质量为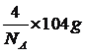 ,根据晶胞的密度的定义,晶胞棱长为
,根据晶胞的密度的定义,晶胞棱长为 cm,根据晶胞的结构,相邻的两个Ca2+距离是面对角线的一半,即距离为
cm,根据晶胞的结构,相邻的两个Ca2+距离是面对角线的一半,即距离为![]() 。
。