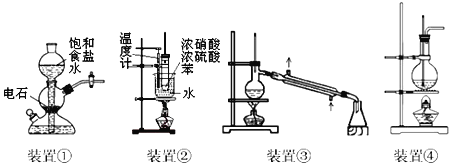
题目内容
【题目】已知反应:2KMnO4+16HCl=2KCl+2MnCl2+5C12↑+8H2O
(1)用双线桥法标明电子转移的方向和数目。
(2)若有7.3g HCl被氧化,求体现酸性作用的HCl为多少摩?氧化产物与还原产物的质量比为多少(分子分母分别算出数值,不用约分)?
【答案】 ;0.12mol;7.1/5.04
;0.12mol;7.1/5.04
【解析】
(1)该反应中Mn从+7价降低到+2价得到5个电子,Cl从-1价升高到0价,失去1个电子,则根据电子得失守恒可知双线桥法表示反应转移的电子的方向和数目为 ;
;
(2)由反应可知,16molHCl反应时只有10molHCl作还原剂被氧化,另外6mol其酸性作用,若有7.3g HCl被氧化,n(HCl)=7.3g÷36.5g/mol=0.2mol,则体现酸性作用的HCl为![]() 。氧化产物是0.1mol氯气,还原产物是氯化锰,物质的量是0.4×0.1mo=0.04mol,二者的质量分别是0.1mol×71g/mol=7.1g、0.04mol×126g/mol=5.04g,所以二者的质量比为7.1/5.04。
。氧化产物是0.1mol氯气,还原产物是氯化锰,物质的量是0.4×0.1mo=0.04mol,二者的质量分别是0.1mol×71g/mol=7.1g、0.04mol×126g/mol=5.04g,所以二者的质量比为7.1/5.04。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】某化工厂排放的工业废水中主要含Na+、HSO3ˉ、SO42-,研究小组欲测定其中HSO3ˉ的浓度,设计如下三个方案。
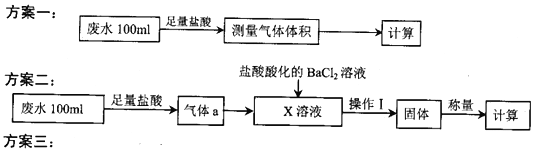
量取20.00mL废水试样,用0.02moL·K-1MnO4标准溶液进行滴定。记录数据,计算。
回答下列问题
(1)利用右图所示的装置完成方案一
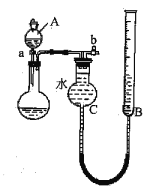
①仪器A的名称是______________。
②读数前,应进行的操作是____________________________。
③该方案存在较大的误差,可能的一种原因是____________________________。
(2)①方案二中吸收气体a的“X溶液”可能是______________ (填标号)。
a.Na2SO3溶液 b.双氧水 c.硝酸钠溶液 d.H2SO4酸化的KMnO4溶液
②若Ⅹ为次氯酸钠,写出气体a与X溶液反应的离子方程式____________________________。
③该方案中,操作I包含的操作名称依次为______________。
(3)①方案三设计的下列滴定方式中,最合理的是______________ (填标号)。该方案是否需要指示剂? ______________ (填“是”或“否”),原因是__________________________________________。
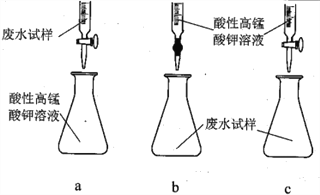
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 21.45 |
第四次 | 0.00 | 16.00 |
计算该废水试样中HSO3ˉ的浓度为______________ mol ·L-l。