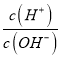题目内容
【题目】根据所给出的装置图回答下列问题:
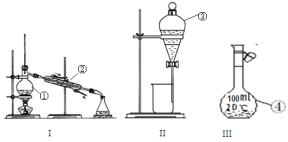
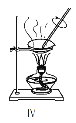
(1)①~④中,使用前必须检查是否漏水的是____________(填仪器序号)。
(2)分离溴水中的溴应先选择装置_____(填Ⅰ、Ⅱ、Ⅲ或Ⅳ序号,下同),进行操作A_______(填操作名称,下同);再选装置_____,进行操作B________;操作A需在溴水中加一种试剂,选择这一试剂时,下列性质你认为哪些是必需的:_______(填字母)。
A. 常温下为液态 B. Br2在其中溶解程度小 C. 与水互不相溶
D. 密度比水大 E. 与Br2不反应 F. 溶解Br2后呈现橙红色
【答案】③④ Ⅱ 萃取(或萃取分液) Ⅰ 蒸馏 ACE
【解析】
(1)根据分液漏斗和100mL容量瓶在使用前要检查是否漏水;
(2)萃取利用溶质在不同溶剂中溶解度不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来,然后分液;根据溴与四氯化碳的沸点不同可用蒸馏分离;萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应。
(1)因分液漏斗和100mL容量瓶在使用前要检查是否漏水,蒸馏烧瓶、冷凝管不需要检查是否漏水,
因此,本题正确答案是:③④;
(2)溴在四氯化碳中的溶解度较在水中大,并且四氯化碳和水互不相溶,可用萃取的方法分离,接着可用分液方法将两层液体分开,应选择装置Ⅱ;
四氯化碳易挥发,可用蒸馏的方法分馏得到四氯化碳,应选择装置Ⅰ;
溴在萃取剂中的溶解度大于在水中的溶解度,萃取剂和水不互溶,且萃取剂和溴不反应,
因此,本题正确答案是:Ⅱ; 萃取(或萃取分液);Ⅰ; 蒸馏;ACE。

练习册系列答案
相关题目