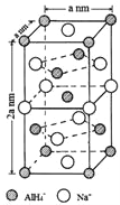
题目内容
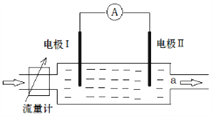
【题目】科研人员设计一种电化学反应器以Na2SO4溶液为电解质,负载纳米MnO2的导电微孔钛膜和不锈钢为电极材料。这种反应器可用于正丙醇氧化合成丙酸,装置示意图如下图。以下叙述错误的是( )

A. 不锈钢作阴极
B. 微孔钛膜电极发生的电极反应CH3CH2CH2OH+H2O+4e-=CH3CH2COOH+4H+
C. 使用Na2SO4溶液是为了在电解时增强溶液导电性
D. 反应器工作时料槽中正丙醇分子向微孔钛膜移动
【答案】B
【解析】该装置可用于正丙醇合成丙酸,正丙醇合成丙酸,属于氧化反应,所以微孔钛膜做阳极,不锈钢作阴极,A正确;微孔钛膜电极为阳极,丙醇在该极发生氧化反应,极反应:CH3CH2CH2OH+H2O-4e-=CH3CH2COOH+4H+,B错误;Na2SO4属于强电解质,不参与反应,但Na2SO4溶液可增强溶液导电性,C正确;微孔钛膜做阳极,正丙醇在此极被氧化,所以反应器工作时料槽中正丙醇分子向电催化膜移动,D正确;正确选项B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一
I.NO和CO气体均为汽车尾气的成分,目前降低尾气的可行方法是在汽车排气管上安装催化转化器,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知反应中相关键能数据如下:
化学键 | C | N | N | C=O |
键能/kJ·mol-1 | 1076 | 632 | 946 | 750 |
(1)由此计算△H=__________。
(2)在一定温度下,将2.0molNO、2.4molCO通入到容积固定为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
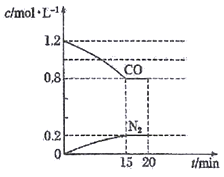
①有害气体NO的转化率为__________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是__________ (填序号)。
a.缩小容器体积 b.催化剂 c.降低温度 d.再通入2.0molNO
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,平衡将__________ (填“正向”或“逆向”)移动。
Ⅱ.SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)△H<0
4N2(g)+6H2O(g)△H<0
(3)该法可能发生副反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),减少副反应的主要措施是___________(写一条即可)。
4NO(g)+6H2O(g),减少副反应的主要措施是___________(写一条即可)。
(4)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。
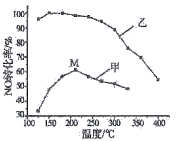
①工业上选择催化剂__________(填“甲”或“乙”),原因是____________。
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率______(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是__________。(写一条即可)