题目内容
20.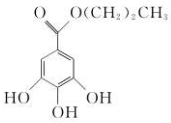 没食子酸丙酯的结构简式为,有吸湿性,对光不稳定,发生分解,耐高温性差.下列有关说法正确的是( )
没食子酸丙酯的结构简式为,有吸湿性,对光不稳定,发生分解,耐高温性差.下列有关说法正确的是( )| A. | 分子式为C10H13O5 | B. | 可以发生取代反应和加成反应 | ||
| C. | 易溶于水、乙醇、苯等溶剂 | D. | 装于无色玻璃瓶中,密封保存 |
分析 A.根据没食子酸丙酯的结构简式书写分子式;
B.含有酚羟基,具有酚的性质,含有酯基,具有酯的性质,含有苯环,具有苯的性质;
C.具有酯基与酚的性质,难溶于水;
D.对光不稳定,易发生分解,有吸湿性,应避光密封保存.
解答 解:A.根据没食子酸丙酯的结构简式,可知分子式为C10H12O5,故A错误;
B.含有酚羟基、酯基,可以发生取代反应,含有苯环,可以发生加成反应,故B正确;
C.具有酯基与酚的性质,难溶于水,故C错误;
D.没食子酸丙酯对光不稳定,易发生分解,有吸湿性,应装于棕色玻璃瓶中避光密封保存,故D错误,
故选:B.
点评 本题考查有机物的结构与性质,掌握官能团结构及其性质是关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.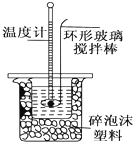 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1 NaOH溶液.若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体0.50mol•L-1×0.25L×40g•mol-1=5.0 g.(请列式计算出结果,无列式,结果不给分)
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):_$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1_.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
②近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1.则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数据结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)a、b、c、d.
a.实验装置保温、隔热效果差
b.配制NaOH溶液定容时仰视刻度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1 NaOH溶液.若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体0.50mol•L-1×0.25L×40g•mol-1=5.0 g.(请列式计算出结果,无列式,结果不给分)
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):_$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1_.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)℃ | ||
| H2SO | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数据结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)a、b、c、d.
a.实验装置保温、隔热效果差
b.配制NaOH溶液定容时仰视刻度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
11.下列分子中,分子间不能形成氢键的是( )
| A. | NH3 | B. | HF | C. | C2H5OH | D. | CH4 |
8.在下述条件下,一定能大量共存的离子组是( )
| A. | 澄清透明的水溶液中:K+、Ba2+、OH-、MnO4- | |
| B. | pH=13的溶液中:Cl-,HCO3-,NO3-,NH4+ | |
| C. | c(Fe3+)=0.1mol•L-1的溶液中:Na+、SCN-、Cl-、Br- | |
| D. | 强碱性溶液中:ClO-、SO42-、SO32-、Na+ |
15.下列四项都能导电,其中一项与其他三项导电原理不同的是( )
| A. | 氯化钠熔化导电 | B. | 液态汞导电 | ||
| C. | H2SO4溶液导电 | D. | 熔融状态的K0H导电 |
5.能正确表示下列反应的离子方程式的是( )
| A. | 标况下将112mL氯气通入10mL 1mol•L-1的碘化亚铁溶液中:Cl2+2I-═2Cl-+I2 | |
| B. | 用FeS去除工厂废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | |
| D. | 用醋酸除去水壶中的水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
18.肉桂酸是香料、化妆品、医药、浆料和感光树脂等的重要原料.实验室用如图1反应制取肉桂酸.

药品物理常数
填空:
I.合成:反应装置如图2所示.向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀.在150~170℃加热l小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)为了使温度便于控制,且受热均匀,该装置应采用的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
Ⅱ.粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
[反应混合物]$→_{硫酸钠溶液}^{加入饱和}$ $→_{苯甲醛}^{蒸馏除去}$ $\stackrel{盐酸酸化}{→}$ $\stackrel{操作1}{→}$ $→_{干燥}^{过滤、洗涤}$[肉桂酸品体】
(4)加饱和Na2CO3溶液除了转化醋酸,还有一个目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是冷却结晶;
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
(7)若最后得到纯净的肉桂酸5.0g.则该反应中的产率是75%(保留两位有效数字).

药品物理常数
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
| 相对分子质量 | 106 | 102 | 148 | 60 |
I.合成:反应装置如图2所示.向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀.在150~170℃加热l小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)为了使温度便于控制,且受热均匀,该装置应采用的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
Ⅱ.粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
[反应混合物]$→_{硫酸钠溶液}^{加入饱和}$ $→_{苯甲醛}^{蒸馏除去}$ $\stackrel{盐酸酸化}{→}$ $\stackrel{操作1}{→}$ $→_{干燥}^{过滤、洗涤}$[肉桂酸品体】
(4)加饱和Na2CO3溶液除了转化醋酸,还有一个目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是冷却结晶;
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
(7)若最后得到纯净的肉桂酸5.0g.则该反应中的产率是75%(保留两位有效数字).