题目内容
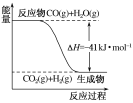
【题目】已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下表:
化学键 | O=O | H—H | H—O(g) |
1 mol化学键断裂时 需要吸收的能量/kJ | 496 | x | 463 |
则表中x为( )
A.920B.557C.436D.188
【答案】C
【解析】
1g氢气完全燃烧生成液态水时放出热量143kJ,故2mol氢气燃烧生成2mol液态水时放出热量为![]() ×143kJ=572kJ,18g水蒸气变成液态水放出44kJ的热量,2mol液态水变为气态水吸收的热量为
×143kJ=572kJ,18g水蒸气变成液态水放出44kJ的热量,2mol液态水变为气态水吸收的热量为![]() ×44kJ=88kJ,故2mol氢气燃烧生成2mol气态水时放出热量为572kJ88kJ=484kJ,故热化学方程式为2H2(g)+O2(g)=2H2O(g)
×44kJ=88kJ,故2mol氢气燃烧生成2mol气态水时放出热量为572kJ88kJ=484kJ,故热化学方程式为2H2(g)+O2(g)=2H2O(g) ![]() H=484kJ/mol,所以2xkJ/mol+496kJ/mol4×463kJ/mol=484kJ/mol,解得x=436,故选C。
H=484kJ/mol,所以2xkJ/mol+496kJ/mol4×463kJ/mol=484kJ/mol,解得x=436,故选C。

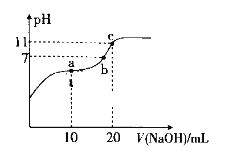
【题目】已知测定中和热的实验步骤如下:
![]() 量取50mL
量取50mL![]() 硫酸倒入小烧杯中,测量温度;
硫酸倒入小烧杯中,测量温度;
![]() 量取50mL
量取50mL![]() NaOH溶液,测量温度;
NaOH溶液,测量温度;
![]() 将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)![]() 溶液稍过量的原因______.
溶液稍过量的原因______.
(2)加入NaOH溶液的正确操作是______![]() 填字母
填字母![]() .
.
A.沿玻璃棒缓慢加入![]() 一次迅速加入
一次迅速加入![]() 分三次加入
分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是______.
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值
| ||
| NaOH | 平均值 | |||
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
(4)设溶液的密度均为![]() ,中和后溶液的比热容
,中和后溶液的比热容![]() ,请根据实验数据求出中和热为______写出该反应的热化学方程式______
,请根据实验数据求出中和热为______写出该反应的热化学方程式______
(5)若将含![]()
![]() 的浓硫酸与含1molNaOH的溶液混合,放出的热量______
的浓硫酸与含1molNaOH的溶液混合,放出的热量______![]() 填“小于”、“等于”或“大于”
填“小于”、“等于”或“大于”![]() ,原因是______.
,原因是______.
【题目】工业生产硫酸接触室发生如下化学反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ·mol-1。一定温度下,向甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示,下列判断中,正确的是( )
2SO3(g) ΔH=-196.6kJ·mol-1。一定温度下,向甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示,下列判断中,正确的是( )
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.6 | 1.2 | 1.2 |
n(O2)/mol | 0.36 | 0.36 | 0.72 | |
SO2的平衡转化率 | 80% | α1 | α2 | |
A.甲→乙,平衡向正反应方向移动,α(O2)增大,放出的热量为47.18kJ
B.平衡时,丙中c(SO2)是甲中的2倍
C.平衡时,SO2的转化率:α2>80%>α1
D.该温度下,平衡常数K=400