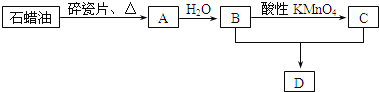
题目内容
【题目】Ⅰ.已知一氧化碳与水蒸气反应过程的能量变化如图所示:
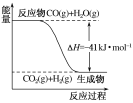
(1)反应的热化学方程式为___________________________。
(2)已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2kJ/mol;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0kJ/mol
Na(s) = Na(l) △H =+2.6 kJ/mol
请写出用液态钠与四氯化钛置换出钛的热化学方程式_____________________________________
II.在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定条件下发生如下反应:H2(g)+I2(g)![]() 2HI(g) ΔH<0,反应中各物质的浓度随时间变化情况如下图甲所示:
2HI(g) ΔH<0,反应中各物质的浓度随时间变化情况如下图甲所示:

(3)该反应的化学平衡常数表达式为________。
(4)根据图甲数据,反应开始至达到平衡时,平均速率v(HI)为________。
(5)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K________(填“增大”“减小”或“不变”),HI浓度的变化正确的是________(用图乙中a~c的编号回答)。
②若加入I2,H2浓度的变化正确的是________(用图乙中d~f的编号回答)。
【答案】CO(g)+H2O(g)==CO2(g)+H2(g) △H = -41kJ/mol 4Na(s)+ TiCl4(l)= Ti(s)+ 4NaCl(s) △H = -970.2kJ/mol K=![]() 0.17 mol·L-1·min-1 减小 c f
0.17 mol·L-1·min-1 减小 c f
【解析】
(1)根据图象中反应物总能量与生成物总能量进行分析得出热化学方程式;
(2)根据盖斯定律进行求算;
(3)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
(4)根据v=![]() 计算平均速率v(HI);
计算平均速率v(HI);
(5)①根据化学平衡常数K只与温度有关,温度改变,若平衡正向移动,化学平衡常数K增大,生成物浓度增大,反之,若平衡逆向移动,化学平衡常数K减少,生成物浓度减少;
②若加入I2,平衡正向移动,H2浓度减少。
(1)图象分析判断反应物能量高于生成物的能量,反应是放热反应;反应的焓变为41 kJ/mol;反应的热化学方程式为:CO(g)+H2O(g)==CO2(g)+H2(g) △H = -41kJ/mol;
(2)由已知反应得:
Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2kJ/mol①
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0kJ/mol②
Na(s) = Na(l) △H =+2.6 kJ/mol③
根据盖斯定律,将①+②-③得:4Na(s)+ TiCl4(l)= Ti(s)+ 4NaCl(s) ΔH=+804.2 kJ/mol-1 764.0 kJ/mol-10.4 kJ/mol=-970.2 kJ/mol;
(3)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值。根据方程式H2(g)+I2(g)![]() 2HI(g)可知,该反应的平衡常数表达式是K=
2HI(g)可知,该反应的平衡常数表达式是K=![]() ;
;
(4)平均速率v(HI)=![]() =0.17 mol·L-1·min-1;
=0.17 mol·L-1·min-1;
(5)①该反应放热,升高温度,平衡逆向移动,化学平衡常数K减少,生成物浓度减少,故答案为:减小;c;
②若加入I2,平衡正向移动,H2浓度减少,故答案为:f。

【题目】已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下表:
化学键 | O=O | H—H | H—O(g) |
1 mol化学键断裂时 需要吸收的能量/kJ | 496 | x | 463 |
则表中x为( )
A.920B.557C.436D.188