题目内容
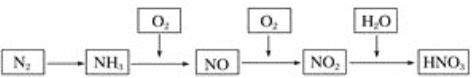
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
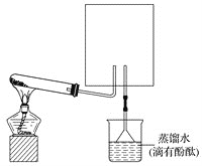
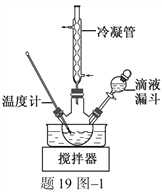
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
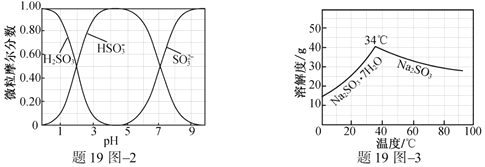
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
【答案】(15分)
(1)3Cl2+6OH![]() 5Cl+ClO3+3H2O 缓慢通入Cl2
5Cl+ClO3+3H2O 缓慢通入Cl2
(2)NaClO碱性溶液 减少水合肼的挥发
(3)①测量溶液的pH,若pH约为4,停止通SO2
②边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤
【解析】分析:步骤I中Cl2与NaOH溶液反应制备NaClO;步骤II中的反应为NaClO碱性溶液与尿素水溶液反应制备水合肼,;步骤III分离出水合肼溶液;步骤IV由SO2与Na2CO3反应制备Na2SO3。
(1)温度超过40℃,Cl2与NaOH溶液发生歧化反应生成NaClO3、NaCl和H2O。由于Cl2与NaOH溶液的反应为放热反应,为了减少NaClO3的生成,应控制温度不超过40℃、减慢反应速率。
(2)步骤II中的反应为NaClO碱性溶液与尿素水溶液反应制备水合肼,由于水合肼具有强还原性、能与NaClO剧烈反应生成N2,为了防止水合肼被氧化,应逐滴滴加NaClO碱性溶液。NaClO碱性溶液与尿素水溶液在110℃继续反应,N2H4·H2O沸点约118 ℃,使用冷凝管的目的:减少水合肼的挥发。
(3)①向Na2CO3溶液中通入SO2制备NaHSO3溶液,根据图示溶液pH约为4时,HSO3-的摩尔分数最大,则溶液的pH约为4时停止通入SO2。
②由NaHSO3溶液制备无水Na2SO3,首先要加入NaOH将NaHSO3转化为Na2SO3,根据含硫微粒与pH的关系控制pH;根据Na2SO3的溶解度曲线,确定分离Na2SO3的方法。
详解:(1)温度超过40℃,Cl2与NaOH溶液发生歧化反应生成NaClO3、NaCl和H2O,反应的化学方程式为3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,离子方程式为3Cl2+6OH-
5NaCl+NaClO3+3H2O,离子方程式为3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O。由于Cl2与NaOH溶液的反应为放热反应,为了减少NaClO3的生成,应控制温度不超过40℃、减慢反应速率;实验中控制温度除用冰水浴外,还需采取的措施是:缓慢通入Cl2。
5Cl-+ClO3-+3H2O。由于Cl2与NaOH溶液的反应为放热反应,为了减少NaClO3的生成,应控制温度不超过40℃、减慢反应速率;实验中控制温度除用冰水浴外,还需采取的措施是:缓慢通入Cl2。
(2)步骤II中的反应为NaClO碱性溶液与尿素水溶液反应制备水合肼,由于水合肼具有强还原性、能与NaClO剧烈反应生成N2,为了防止水合肼被氧化,应逐滴滴加NaClO碱性溶液,所以通过滴液漏斗滴加的溶液是NaClO碱性溶液。NaClO碱性溶液与尿素水溶液在110℃继续反应,N2H4·H2O沸点约118 ℃,使用冷凝管的目的:减少水合肼的挥发。
(3)①向Na2CO3溶液中通入SO2制备NaHSO3溶液,根据图示溶液pH约为4时,HSO3-的摩尔分数最大,则溶液的pH约为4时停止通入SO2;实验中确定何时停止通入SO2的实验操作为:测量溶液的pH,若pH约为4,停止通SO2。
②由NaHSO3溶液制备无水Na2SO3,首先要加入NaOH将NaHSO3转化为Na2SO3,根据含硫微粒与pH的关系,加入NaOH应调节溶液的pH约为10;根据Na2SO3的溶解度曲线,温度高于34℃析出Na2SO3,低于34℃析出Na2SO3·7H2O,所以从Na2SO3溶液中获得无水Na2SO3应控制温度高于34℃。由NaHSO3溶液制备无水Na2SO3的实验方案为:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封包装。

【题目】铜的电解实现了铜与杂质的分离,也造成了一部分资重金属进入阳极泥中,通过对阳极泥的综合处理可以回收可观的宝贵金属。稀散元素硒和碲广泛用于治金工业、电子工业、国防工业、医学和农业等领域,需求量越来越大。电解精炼铜的阳极泥主要成分为Cu2Se、Cu2Te和少量金属单质Au等,工业上从其中同收碲、硒的一种工艺流程如图:
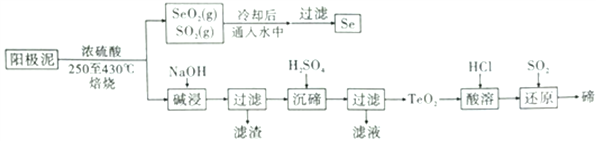
已知:TeO2是两性氧化物,Se和TeO2的物理性质如下表:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)“焙烧”时所加的硫酸浓度最好为_____(填序号)。
a.10% b.50% c.70% d.98%
(2)加硫酸焙烧过程中Cu2Se参与反应的化学方程式为_________,氧化产物和还原产物的物质的量之比是_______。
(3)滤渣的主要成分是_______ (填化学式)。
(4)“酸溶”后,将TeO2先溶于盐酸得到四氯化碲,然后再通入二氧化硫得到碲单质,后者发生反应的化学方程式为______________ 。
(5)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致“沉碲”不完全,原因是______________ 。
(6)过滤所得粗硒中含有Ni、Fe、Cu等杂质,可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示。蒸馏操作中控制的最佳温度是_____(填序号)
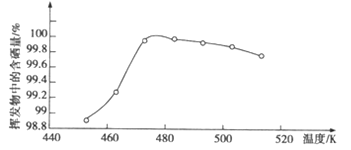
a. 455℃ b.462℃ c.475℃ d.515℃
(7)工业上还可以通过电解铜阳极泥碱浸,过滤后的滤液得到单质碲。己知电解时的电极均为石墨,则阴极的电极反应式为___________。