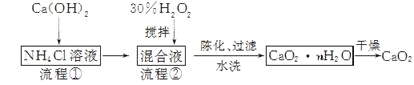
题目内容
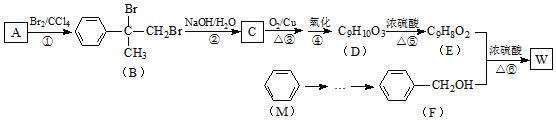
【题目】室温下向10ml0.2mol/L的H2A溶液中加入0.2mol/LNaOH溶液,溶液pH的变化曲线如图所示。下列说法正确的是( )
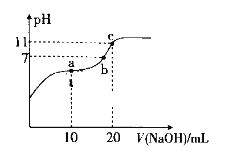
A.b点溶液中离子浓度的大小:c(H2A)>c(A2-)
B.加水稀释c点溶液,水电离出的c(H+)·c(OH-)不变
C.a点的溶液可以用钢瓶贮存
D.c点溶液中存在:c(Na+)>2c(A2-)+c(HA-)
【答案】D
【解析】
由题干可知,a点对应的溶质为NaHA,其溶液呈酸性,由此可知HA-的电离程度大于其水解程度,c点对应溶质为Na2A,由此进行解答本题。
A、根据电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),b点溶液呈中性,c(H+)=c(OH-),故c(Na+) =2c(A2-)+c(HA-),a点溶质为NaHA,存在物料守恒:c(Na+) =c(A2-)+c(HA-)+c(H2A),由a→b的过程中,加入了Na+,故b点c(Na+) >c(A2-)+c(HA-)+c(H2A),即2c(A2-)+c(HA-) >c(A2-)+c(HA-)+c(H2A),由此可知c(A2-)> c(H2A),故A错误;
B、c点的溶质为Na2A,加水稀释过程中,A2-离子水解程度增大,促进水的电离,水电离出的c(H+)·c(OH-)增大,故B错误;
C、a点溶液呈酸性,不能用钢瓶贮存,故C错误;
D、c点溶液中存在电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),其溶液呈碱性,故c(H+)<c(OH-),因此c(Na+)>2c(A2-)+c(HA-),故D正确。

【题目】已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下表:
化学键 | O=O | H—H | H—O(g) |
1 mol化学键断裂时 需要吸收的能量/kJ | 496 | x | 463 |
则表中x为( )
A.920B.557C.436D.188