题目内容
6.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 1.00molNaCl固体中含有6.02×1023个NaCl分子 | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 1molFe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
分析 A、NaCl固体为离子化合物,没有分子;
B、根据NO2和N2O4的最简式均为NO2来计算;
C、根据Fe2+反应后被氧化为Fe3+来分析;
D、不知道溶液体积,无法求出氢氧根离子的数目.
解答 解:A、NaCl固体为离子化合物,没有分子,故A错误;
B、NO2和N2O4的最简式均为NO2,故46gNO2和N2O4混合气体中含有的NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含有的原子为3mol,个数为3NA个,故B正确;
C、Fe2+反应后被氧化为Fe3+,故1molFe2+反应转移1mol电子,个数为NA个,故C错误;
D、不知道溶液体积,无法求出氢氧根离子的数目,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
10.某学生为了完成一个家庭小实验,自制烷烃的分子模型,对于CnH2n+2的烷烃,做球棍模型时,除需做3n+2个球外还需要的棍(共价键)数为( )
| A. | 3n+2 | B. | 3n+1 | C. | 3n | D. | 3n-1 |
14.化学知识在生产、生活中有着广泛的应用.下列说法中正确的是( )
| A. | 铅蓄电池属于二次电池 | |
| B. | 氢氟酸可用于蚀刻玻璃是因为其具有强酸性 | |
| C. | 为了防止食品受潮,常在食品包装袋中放入活性铁粉 | |
| D. | 用于制光缆的光导纤维是新型有机高分子材料 |
1.实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气,供选用的实验试剂及装置如下(部分导管、蒸馏水略去).
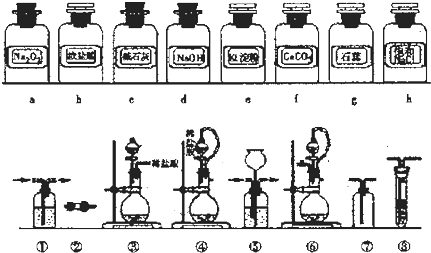
I.写出制取氯气的化学方程式或离子方程式:
①MnO2与浓盐酸制取氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②Na2 O2与浓盐酸制备氯气的化学方程式Na2O2+4HCl=2NaCl+Cl2↑+2H2O.
Ⅱ.完成用Na2O2与浓盐酸制备氯气的有关问题:
(1)下列装置组合最合理的是D(填序号,需考虑实验结束撤除装置时残留有害气体的处理).
(2)尾气经处理后仍有较多气体排出,其主要原因用化学方程式表示为2Na2O2+2H2O=4NaOH+O2↑(或4Na2O2+4HCl=4NaCl+2H2O+O2↑)
(3)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①Na2O2能与水反应,会使原料的利用率降低,
②双氧水比Na2O2更经济.
(4)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?否(填“是”或“否”);理由是产物不纯且难以分离.

I.写出制取氯气的化学方程式或离子方程式:
①MnO2与浓盐酸制取氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②Na2 O2与浓盐酸制备氯气的化学方程式Na2O2+4HCl=2NaCl+Cl2↑+2H2O.
Ⅱ.完成用Na2O2与浓盐酸制备氯气的有关问题:
(1)下列装置组合最合理的是D(填序号,需考虑实验结束撤除装置时残留有害气体的处理).
| 组合 | 制备装置 | 净化装置 | 检验装置/-试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ④⑥ | ⑤ | ⑧/g | ① |
(3)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①Na2O2能与水反应,会使原料的利用率降低,
②双氧水比Na2O2更经济.
(4)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?否(填“是”或“否”);理由是产物不纯且难以分离.
11.类比归纳是学习化学的重要方法之一,对如下类比的说法正确的是( )
| A. | CO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色 | |
| B. | MgO、BaO都是离子化合物,熔化时都能导电 | |
| C. | CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | CuO、Fe2O3都是不溶于水的碱性氧化物,都是黑色粉末 |
18.下列溶液一定呈中性的是( )
| A. | pH=7的溶液 | |
| B. | c(H+)=c(OH-)的溶液 | |
| C. | 由强酸、强碱等物质的量反应得到的溶液 | |
| D. | 盐溶于水得到的溶液 |
15.合理开发和利用海水资源是世界各国研究的课题.下列对于海水利用的认识错误的是( )
| A. | 海水中蕴藏有丰富的资源,人类可以大量开发,以弥补资源的短缺 | |
| B. | 海水可以成为廉价的资源基地,但要合理开发,综合利用 | |
| C. | 可以用太阳能电解海水以获取氢能源 | |
| D. | 人类在利用海水时要兼顾海洋生物和海洋生态平衡 |
16.下列推断正确的是( )
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2CO3、NaHCO3都是盐,都能与CaCl2溶液反应 | |
| C. | CO、NO都是大气污染气体,在空气中都能稳定存在 | |
| D. | Fe和Al都是金属,都不能与碱溶液反应 |
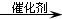
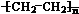 .A和水在一定条件下反应生成B,B为生活中常见的有机物,B可与另一种生活中常见有机物在一定条件下反应生成有香味的物质C,写出生成C的化学方程式
.A和水在一定条件下反应生成B,B为生活中常见的有机物,B可与另一种生活中常见有机物在一定条件下反应生成有香味的物质C,写出生成C的化学方程式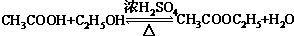 .比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理.乙烯和氯化氢在一定条件下制得氯乙烷的化学反应方程式是(有机物用结构简式表示)CH2=CH2+HC1
.比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理.乙烯和氯化氢在一定条件下制得氯乙烷的化学反应方程式是(有机物用结构简式表示)CH2=CH2+HC1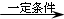 CH3CH2C1,该反应类型是加成反应.
CH3CH2C1,该反应类型是加成反应.