题目内容
【题目】下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理,下列说法不正确的是

A. 反应②为反应③提供了原料
B. 反应②也是SO2资源利用的方法之一
C. 制得等量H2所需能量较少的是系统(I)
D. 系统(I)制氢的热化学方程式为H2O(l) ![]() H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
【答案】C
【解析】A. 可以看出来反应②为反应③提供了原料HI,故A正确;B. SO2在反应②中实现了再利用,故B正确;C.由已知化学方程式可知①+②+③可得系统(Ⅰ)制氢的热化学方程式为:H2O(l) ![]() H2(g) + 1/2O2(g) ΔH = +286 kJ/mol,②+③+④可得系统(Ⅱ)制氢的热化学方程式为:H2S(g)
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol,②+③+④可得系统(Ⅱ)制氢的热化学方程式为:H2S(g) ![]() H2(g) + S(g) ΔH = +20 kJ/mol;由上面的热化学方程式可知:制得等量H2所需能量较少的是系统(Ⅱ),故C错误;D. ①+②+③可得系统(Ⅰ)制氢的热化学方程式为:H2O(l)
H2(g) + S(g) ΔH = +20 kJ/mol;由上面的热化学方程式可知:制得等量H2所需能量较少的是系统(Ⅱ),故C错误;D. ①+②+③可得系统(Ⅰ)制氢的热化学方程式为:H2O(l) ![]() H2(g) + 1/2O2(g) ΔH = +286 kJ/mol,故D正确;本题选C。
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol,故D正确;本题选C。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】一位同学模仿氨碱法,将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠。实验装置如图所示。

(1)乙中盛装的试剂是_________;烧杯(丁)中稀硫酸的作用是_________________________;实验结束后,通过,_________操作分离出NaHCO3晶体。
(2)单独将CO2通入饱和食盐水不可能产生碳酸氢钠沉淀,NH3在此的作用主要基于它的_________性,丙中发生的反应方程式为______________________________________。
(3)将所得NaHCO3洗涤灼烧后得到碳酸钠。验证产品中是否混有NaCl的方法是_________________。
(4)为测定NaHCO3含量,称取5.000g试样,配制成100mL溶液,用标准盐酸滴定,测定数据记录如下:
滴定次数 | 待测液(mL) | 0.5000mol·L-1盐酸的体积(mL) | |
初读数 | 终读数 | ||
第一次 | 20.00 | 1.00 | 21.00 |
第二次 | 20.00 | 如下图 | 如下图 |
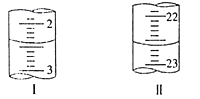
若以甲基橙为指示剂,在滴定终点时的颜色变化为___________________________________,该实验测定NaHCO3含量为w(NaHCO3)=_________(小数点后保留两位)。
