题目内容
【题目】一位同学模仿氨碱法,将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠。实验装置如图所示。

(1)乙中盛装的试剂是_________;烧杯(丁)中稀硫酸的作用是_________________________;实验结束后,通过,_________操作分离出NaHCO3晶体。
(2)单独将CO2通入饱和食盐水不可能产生碳酸氢钠沉淀,NH3在此的作用主要基于它的_________性,丙中发生的反应方程式为______________________________________。
(3)将所得NaHCO3洗涤灼烧后得到碳酸钠。验证产品中是否混有NaCl的方法是_________________。
(4)为测定NaHCO3含量,称取5.000g试样,配制成100mL溶液,用标准盐酸滴定,测定数据记录如下:
滴定次数 | 待测液(mL) | 0.5000mol·L-1盐酸的体积(mL) | |
初读数 | 终读数 | ||
第一次 | 20.00 | 1.00 | 21.00 |
第二次 | 20.00 | 如下图 | 如下图 |
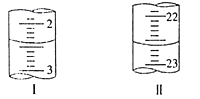
若以甲基橙为指示剂,在滴定终点时的颜色变化为___________________________________,该实验测定NaHCO3含量为w(NaHCO3)=_________(小数点后保留两位)。
【答案】 饱和NaHCO3溶液 吸收可能逸出的氨气,防止污染环境 过滤 碱 CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3↓(或分两步写) 取少量样品于洁净试管中,加水溶解,稀硝酸酸化后滴加AgNO3 溶液,若有白色沉淀产生,则说明混有NaCl,反之则无(或其他合理答案) 由黄色变为橙色 84.42%
【解析】试题分析:本题考查NaHCO3的制备、物质的检验、滴定实验、NaHCO3含量的测定。
(1)甲装置为CO2的发生装置,由于盐酸具有挥发性,制得的CO2中混有HCl和H2O(g),HCl会与NH3反应生成NH4Cl,乙中盛装的试剂用于除去HCl,乙中盛装的试剂是饱和NaHCO3溶液;装置丙中发生反应NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;烧杯丁中稀硫酸的作用是:吸收可能逸出的NH3,防止污染环境。实验结束后,通过过滤操作分离出NaHCO3晶体。
(2)单独将CO2通入饱和食盐水中不可能产生NaHCO3沉淀,CO2通入饱和氨化食盐水中,NH3与CO2、H2O作用生成NH4HCO3(NH3+H2O+CO2=NH4HCO3),NH3在此的作用主要基于NH3的碱性。丙中发生反应的化学方程式为NH3+H2O+CO2=NH4HCO3、NH4HCO3+NaCl=NaHCO3↓+NH4Cl,总反应的化学方程式为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。
(3)检验产品中是否混有NaCl即检验Cl-,方法是:取少量样品于洁净试管中,加水溶解,稀硝酸酸化后滴加AgNO3 溶液,若有白色沉淀产生,则说明混有NaCl,反之则无。
(4)甲基橙的变色范围为3.1~4.4,以甲基橙为指示剂,滴定终点的颜色变化为:溶液由黄色变为橙色。第一次实验消耗盐酸溶液的体积为21.00mL-1.00mL=20.00mL;第二次实验的初读数为2.40mL,终读数为22.60mL,第二次实验消耗盐酸溶液的体积为22.60mL-2.40mL=20.20mL;两次实验消耗盐酸溶液体积的平均值为![]() =20.10mL;根据反应NaHCO3+HCl=NaCl+H2O+CO2↑,20.00mL待测液中n(NaHCO3)=n(HCl)=0.5000mol/L
=20.10mL;根据反应NaHCO3+HCl=NaCl+H2O+CO2↑,20.00mL待测液中n(NaHCO3)=n(HCl)=0.5000mol/L![]() 20.10
20.10![]() 10-3L=1.005
10-3L=1.005![]() 10-2mol;5.000g试样中n(NaHCO3)=1.005
10-2mol;5.000g试样中n(NaHCO3)=1.005![]() 10-2mol
10-2mol![]() =0.05025mol,m(NaHCO3)=0.05025mol
=0.05025mol,m(NaHCO3)=0.05025mol![]() 84g/mol=4.221g,ω(NaHCO3)=
84g/mol=4.221g,ω(NaHCO3)=![]() 100%=84.42%。
100%=84.42%。

 阅读快车系列答案
阅读快车系列答案【题目】某探究性学习实验小组做了如下实验:
实验一:利用H2C2O4 溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 试验温度/K | 溶液颜色褪至无色时所需时间/s | |||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 5 | 0.1 | 3 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 5 | t1 |
(1)通过实验A、B,可探究出_____________ (填外部因素)的改变对反应速率的影响,其中V1=__________,T1=__________;通过实验__________可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由此实验可以得出的结论是_______________;利用实验B 中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4span>)= __________。
实验二:探究酸的强弱对酸与镁条反应速率的影响。
实验步骤:


(a)检查装置的气密性后,添加药品;
(b)反应开始后,每隔1min记录一次生成H2的体积;
(c)将所记录的数据转化为曲线图(上图乙)。
(3)根据反应的图像(图乙)分析:0-lmin盐酸与镁反应比1-2min反应快的原因:_____________。
(4)对照实验:用20mL水代替酸进行实验。
实验现象:当水滴入锥形瓶中,注射器的活塞_________(填“会”或“不会”)向右移动。
问题分析:针对上述现象,上图中气体发生装置是否合理:_______(填“合理”或“不合理”)若合理,则忽略下问;若不合理,请改进上述装置使其变成合理的装置图:_____________ (用必要的文字或装置图进行回答)。
【题目】下列物质分类的正确组合是( )
分类组合 | 纯净物 | 电解质 | 酸性氧化物 | 碱性氧化物 |
A. | 漂白粉 | 氨水 | 二氧化碳 | 氧化铝 |
B. | 干冰 | 碳酸钙 | 一氧化氮 | 四氧化三铁 |
C. | CaCl2·8NH3 | 水 | 三氧化硫 | 过氧化钠 |
D. | 液氨 | 氯化氢 | 二氧化硅 | 氧化钙 |
A.AB.BC.CD.D
