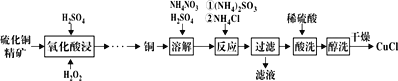
��Ŀ����
����Ŀ���ּס�������ѧС�鰲װ������ͼ��ʾ����ͬװ�ã�����̽��Ӱ��H2O2�ֽ����ʵ����ء�

��1������a������___��
��2��MnO2����H2O2�ֽ�Ļ�ѧ����ʽ��___��
��3����С��������ʵ����Ʒ����������������ɱ�����δ��֡�
ʵ���� | ʵ��Ŀ�� | T/K | ���� | Ũ�� |
����ʵ��� | ��ʵ����� | 298 | 3��FeCl3��Һ | 10mL2%H2O2 |
����ʵ��� | ��__ | 298 | ��__ | 10mL5%H2O2 |
��4���ס�����С��ó���ͼ���ݡ�
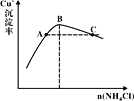
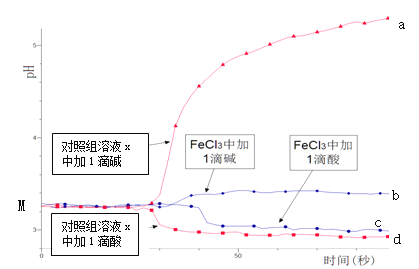
���ɼ���ʵ�����ݿɵó����ֽ���__��
���������о����ᡢ���H2O2�ֽ�Ӱ�����ص�������ͬ�����£�Na2O2��K2O2����ˮ�ų��������ʽϿ����__���������������BaO2������H2SO4��Һ��Ӧ��H2O2���仯ѧ��Ӧ����ʽΪ_��֧����һ������������_��
���𰸡���ƿ 2H2O2![]() 2H2O+O2�� ̽����Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� 3��FeCl3��Һ ��������������ʱ����Ӧ��Ũ��Խ��Ӧ����Խ�� K2O2 Ba2O2+H2SO4=BaSO4+H2O2 �Ʊ�H2O2�Ļ���Ϊ���Ի�����H2O2�ķֽ����ʽ���
2H2O+O2�� ̽����Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� 3��FeCl3��Һ ��������������ʱ����Ӧ��Ũ��Խ��Ӧ����Խ�� K2O2 Ba2O2+H2SO4=BaSO4+H2O2 �Ʊ�H2O2�Ļ���Ϊ���Ի�����H2O2�ķֽ����ʽ���
��������
�Ÿ���ͼʾ����a�ó����ơ�
��H2O2��MnO2�������·ֽ�����O2��H2O��
�Ƿ�Ӧ�������¶ȡ�Ũ�ȡ�������Ӱ�죬����ʵ������ʵ�������¶���ͬ��Ũ�Ȳ�ͬ����˸�ʵ�����̽������Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졣
�����ɼ���ʵ�����ݿɵã�����ʵ�������÷�Ӧ��Ũ�Ƚϴ���ͬʱ���ڲ�������������ϴ�
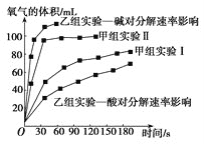
��������ʵ�����ݿ�֪�����������£�H2O2�ķֽ����ʸ��죬����KOH�ļ��Ա�NaOH�ļ���ǿ�����K2O2��H2O��Ӧ�ų���������ʽϿ죻�÷�Ӧ�Ļ�ѧ����ʽΪ��BaO2+H2SO4 = BaSO4+H2O2�����ڸ÷�Ӧ�����������½��У������������£�H2O2�ķֽ����ʽ�����
��ͼʾ����aΪ��ƿ���ʴ�Ϊ����ƿ��
��H2O2��MnO2�������·ֽ�����O2��H2O���÷�Ӧ�Ļ�ѧ����ʽΪ��2H2O2![]() 2H2O+O2�����ʴ�Ϊ��2H2O2
2H2O+O2�����ʴ�Ϊ��2H2O2![]() 2H2O+O2����
2H2O+O2����
�Ƿ�Ӧ�������¶ȡ�Ũ�ȡ�������Ӱ�죬����ʵ������ʵ�������¶���ͬ��Ũ�Ȳ�ͬ����˸�ʵ�����̽������Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬���豣֤��Ӧ�¶Ⱥʹ�����ͬ��������ô���Ϊ3��FeCl3��Һ���ʴ�Ϊ��̽����Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻3��FeCl3��Һ��
�����ɼ���ʵ�����ݿɵã�����ʵ�������÷�Ӧ��Ũ�Ƚϴ���ͬʱ���ڲ�������������ϴ���˿ɵý��ۣ���������������ʱ����Ӧ��Ũ��Խ��Ӧ����Խ�죻�ʴ�Ϊ����������������ʱ����Ӧ��Ũ��Խ��Ӧ����Խ�졣
��������ʵ�����ݿ�֪�����������£�H2O2�ķֽ����ʸ��죻��Na2O2��K2O2��H2O��Ӧ�Ļ�ѧ����ʽ�ֱ�Ϊ��2Na2O2+2H2O = 4NaOH+O2����2K2O2+2H2O = 4KOH+O2��������KOH�ļ��Ա�NaOH�ļ���ǿ�����K2O2��H2O��Ӧ�ų���������ʽϿ죻�÷�Ӧ�Ļ�ѧ����ʽΪ��BaO2+H2SO4 = BaSO4+H2O2�����ڸ÷�Ӧ�����������½��У������������£�H2O2�ķֽ����ʽ�������˿��ø÷�Ӧ�Ʊ�H2O2���ʴ�Ϊ��K2O2��Ba2O2+H2SO4=BaSO4+H2O2���Ʊ�H2O2�Ļ���Ϊ���Ի�����H2O2�ķֽ����ʽ�����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�