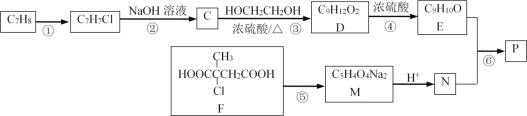
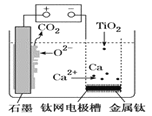
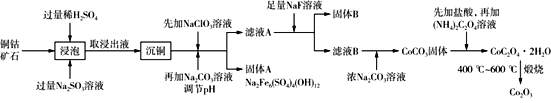
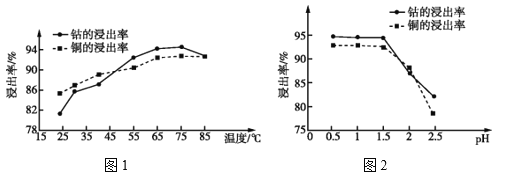
题目内容
【题目】将一定量的H2、CO和CO2的混合气体通入盛有足量Na2O2粉末(Na2O2体积忽略不计)的密闭容器中,用电火花引燃直至反应完全。恢复到原温度,容器内的压强为原来的1/4,则原混合气体的平均相对分子质量可能是
A.20B.23C.30D.36
【答案】C
【解析】
将一定量的H2、CO和CO2的混合气体通入盛有足量Na2O2粉末,发生反应:2Na2O2+2CO2 =2Na2CO3+ O2,产生的O2在电火花作用下与原混合气体中的H2、CO发生燃烧反应:2H2+O2![]() 2H2O;2CO+O2
2H2O;2CO+O2![]() 2CO2;燃烧产物再与Na2O2反应:2Na2O2+2CO2 =2Na2CO3+ O2,2Na2O2+2H2O=4NaOH+ O2↑,叠加得到总方程式Na2O2+CO2 =Na2CO3,Na2O2+ H2O=2NaOH。固体增加的质量即是原混合气体中H2、CO的质量。可见最后剩余的气体只能是O2。对于气体来说,当容器的容积不变时,气体的物质的量的比就是容器内气体的压强之比。由于恢复到原温度,容器内的压强为原来的1/4,则n(气体)(前)=4 n(气体)(后).假设反应产生O2的物质的量是1mol,则原混合气体是4mol,根据方程式2Na2O2+2CO2 =2Na2CO3+ O2气体关系可知n(CO2)=2mol,n(CO)+n(H2)=2mol。若气体是H2与CO2的混合物,则气体的平均相对分子质量是(44+2)÷2=23;若气体是CO与CO2的混合物,则气体的平均相对分子质量是(44+28)÷2=36。由于是三者的混合物,所以气体的平均相对分子质量在23与36之间,符合要求的只有30,故选项是C。
2CO2;燃烧产物再与Na2O2反应:2Na2O2+2CO2 =2Na2CO3+ O2,2Na2O2+2H2O=4NaOH+ O2↑,叠加得到总方程式Na2O2+CO2 =Na2CO3,Na2O2+ H2O=2NaOH。固体增加的质量即是原混合气体中H2、CO的质量。可见最后剩余的气体只能是O2。对于气体来说,当容器的容积不变时,气体的物质的量的比就是容器内气体的压强之比。由于恢复到原温度,容器内的压强为原来的1/4,则n(气体)(前)=4 n(气体)(后).假设反应产生O2的物质的量是1mol,则原混合气体是4mol,根据方程式2Na2O2+2CO2 =2Na2CO3+ O2气体关系可知n(CO2)=2mol,n(CO)+n(H2)=2mol。若气体是H2与CO2的混合物,则气体的平均相对分子质量是(44+2)÷2=23;若气体是CO与CO2的混合物,则气体的平均相对分子质量是(44+28)÷2=36。由于是三者的混合物,所以气体的平均相对分子质量在23与36之间,符合要求的只有30,故选项是C。

【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O | K1=1.75×10-5mol·L-1 |
CH3COO-+H2O | K2=5.71×10-10mol·L-1 |
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
【题目】现甲、乙两化学小组安装两套如图所示的相同装置,用以探究影响H2O2分解速率的因素。

(1)仪器a的名称___。
(2)MnO2催化下H2O2分解的化学方程式是___。
(3)甲小组有如下实验设计方案,请帮助他们完成表格中未填部分。
实验编号 | 实验目的 | T/K | 催化剂 | 浓度 |
甲组实验Ⅰ | 作实验参照 | 298 | 3滴FeCl3溶液 | 10mL2%H2O2 |
甲组实验Ⅱ | ①__ | 298 | ②__ | 10mL5%H2O2 |
(4)甲、乙两小组得出如图数据。
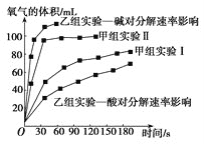
①由甲组实验数据可得出文字结论__。
②由乙组研究的酸、碱对H2O2分解影响因素的数据相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是__;乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2,其化学反应方程式为_;支持这一方案的理由是_。