题目内容
3.短周期元素X、Y、Z和W的原子序数依次增大.X原子的最外层电子数是内层电子数的2倍,Y与X同主族,Z和W原子中未成对电子数之比为2:1.下列说法错误的是( )| A. | XW4为非极性分子 | |
| B. | Y、Z、W的最高价氧化物的水化物酸性强弱顺序是Y<Z<W | |
| C. | X、Y的最高价氧化物由固态转化为气态时,克服相同的作用力 | |
| D. | XW4、YW4、ZW2分子中的中心原子均为sp3杂化 |
分析 短周期元素X、Y、Z和W的原子序数依次增大,X原子的最外层电子数是内层电子数的2倍,最外层电子数不能超过8个,X内层为K层,则X是C元素,Y与X同主族且为短周期元素,则Y为Si元素,Z和W原子中未成对电子数之比为2:1,且Z原子序数小于W而大于14,所以Z是S元素、W是Cl元素,再结合题目分析解答.
解答 解:短周期元素X、Y、Z和W的原子序数依次增大,X原子的最外层电子数是内层电子数的2倍,最外层电子数不能超过8个,X内层为K层,则X是C元素,Y与X同主族且为短周期元素,则Y为Si元素,Z和W原子中未成对电子数之比为2:1,且Z原子序数小于W而大于14,所以Z是S元素、W是Cl元素.
A.CCl4分子中正负电荷重心重合,为非极性分子,故A正确;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Y(Si)<Z(S)<W(Cl),所以Y、Z、W的最高价氧化物的水化物酸性强弱顺序是Y<Z<W,故B正确;
C.X、Y的最高价氧化物分别是CO2、SiO2,前者为分子晶体、后者为原子晶体,固态转化为气态时,物质克服分子间作用力,后者克服共价键,故C错误;
D.XCl4、SiCl4、SCl2分子中的中心原子都含有4个价层电子对数,所以均为sp3杂化,故D正确;
故选C.
点评 本题考查了原子结构和元素周期律关系,关键是根据原子结构确定元素,需要学生熟练掌握基础知识,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
8.下列溶液中能发生水解的离子是( )
| A. | FeCl3溶液中的Cl- | B. | Na2CO3溶液中的CO32- | ||
| C. | 氯化钡溶液中的Ba2+ | D. | 氟化钠溶液中的F- |
15.将一小块钠投入到盛有硫酸铜溶液的小烧杯中,不可能观察到的现象是( )
| A. | 溶液出现蓝色浑浊 | B. | 钠块熔成小球浮在水面四处游动 | ||
| C. | 有气体产生 | D. | 有红色的铜被置换出来 |
12.下列物质中既能与稀硫酸反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
| A. | ③④ | B. | ①②③④ | C. | ①③④ | D. | ①②⑤ |
13.某小组同学利用铝和氧化铁发生铝热反应后得到的固体进行如下实验.
(1)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)固体成分的初步确定.
①由上述实验可知:溶液中Fe元素的存在形式有Fe2+、Fe3+.
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑.进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
提示:KSCN中S元素的化合价为-2价
①实验ⅲ中白色沉淀的化学式是BaSO4.
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
(1)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)固体成分的初步确定.
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑.进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
| 实验序号 | 操作、现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2,无明显变化.再加入H2O2溶液,红色很快褪去 |
①实验ⅲ中白色沉淀的化学式是BaSO4.
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
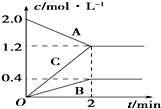 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答: