题目内容
11.重铬酸盐广泛用作氧化剂、皮革制作等.以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程如图1: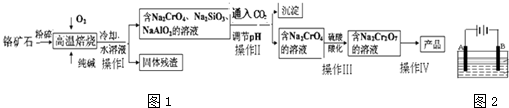
请回答下列问题:
(1)固体残渣主要是含铁(或Fe)元素的氧化物.在高温焙烧时生成Na2CrO4的化学方程式2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2;
(2)操作Ⅱ中通入过量CO2生成沉淀的离子方程式分别为SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(3)下列仪器在分离出含Na2CrO4溶液的操作中,不需要的是ACE
A.酒精灯 B.烧杯 C.蒸发皿 D.漏斗 E.冷凝管
(4)用硫酸酸化时发生反应的离子方程式是2CrO42-+2H+=Cr2072-+H20.
(5)工业酸性废水中的Cr2O72-通常以铁做电极,采用电解法除去.在如图2所示的装置中:
①电极A区Cr2O72-(Cr2O72-还原为Cr3+)发生反应的离子方程式是Cr2072-+6Fe2++14H+=2Cr3++6Fe3++7H20
②假设一段时间后,所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1mol/L,要使Fe3+沉淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是3.2~4.3之间.(已知:lg$\root{3}{0.4}$=-0.1,lg$\root{3}{4}$=0.2,lg$\root{3}{6}$=0.3,lg$\root{3}{60}$=0.6,KSPFe(OH)3=4.0×10-38,KSPCr(OH)3=6.0×10-31).
分析 以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料,加入碳酸钠和氧气高温灼烧发生反应生成铬酸钠,二氧化碳,水浸后过滤得到滤渣FeO,滤液为Na2CrO4,Na2SiO3,NaAlO2;调节溶液PH沉淀硅酸跟离子和偏铝酸根离子,过滤得到滤液Na2CrO4,加入硫酸酸化生成重铬酸钠溶液,通过提纯得到重铬酸钠,以此来解答.
解答 解:以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料,加入碳酸钠和氧气高温灼烧发生反应生成铬酸钠,二氧化碳,水浸后过滤得到滤渣FeO,滤液为Na2CrO4,Na2SiO3,NaAlO2;调节溶液PH沉淀硅酸跟离子和偏铝酸根离子,过滤得到滤液Na2CrO4,加入硫酸酸化生成重铬酸钠溶液,通过提纯得到重铬酸钠,
(1)由上述分析可知,滤渣为FeO,则固体残渣主要是含铁元素的氧化物,在高温焙烧时生成Na2CrO4的化学方程式为2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2,
故答案为:铁(或Fe); 2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2;
(2)操作Ⅱ中通入过量CO2生成沉淀的离子方程式分别为SiO32-+2CO2+2H2O=H2SiO3↓+2 HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)分离出含Na2CrO4溶液,需要过滤,仪器为漏斗、烧杯、玻璃棒,不需要ACE,故答案为:AC E;
(4)用硫酸酸化时发生反应的离子方程式是2CrO42-+2H+=Cr2072-+H20,故答案为:2CrO42-+2H+=Cr2072-+H20;
(5)工业酸性废水中的Cr2O72-通常以铁做电极,则Fe为阳极,失去电子生成亚铁离子,具有还原性,
①电极A区Cr2O72-(Cr2O72-还原为Cr3+)发生反应的离子方程式是Cr2072-+6Fe2++14H+=2Cr3++6 Fe3++7H20,
故答案为:Cr2072-+6Fe2++14H+=2Cr3++6 Fe3++7H20;
②反应后所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1mol/L,要使Fe3+沉 淀完全而Cr3+还未开始沉淀,需要c(Fe3+)=10-5mol/l时铁离子沉淀完全,由溶度积常数Ksp=c(Fe3+)c3(OH-),c3(OH-)=$\frac{4.0×{10}^{-38}}{1×1{0}^{-5}}$=4.0×10-33 ,c(OH-)=$\root{3}{4}$×10-11mol/L,c(H+)=$\frac{1{0}^{-14}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{1{0}^{0.2}×1{{0}^{-11}}^{\;}}$=10-3.2,pH=-lgc(H+)=3.2;
Cr3+还未开始沉淀,c(Cr3+)=0.1mol/L,Ksp=c(Cr3+)c3(OH-)=6.0×10-31,c3(OH-)=$\frac{6.0×1{0}^{-31}}{0.1}$=6.0×10-30;c(OH-)=$\root{3}{6}$×10-10mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{0.3}×1{0}^{-10}}$=10-4.3mol/L,pH=-lgc(H+)=4.3,
则要使Fe3+沉淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是3.2~4.3,
故答案为:3.2~4.3之间.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中的反应及混合物分离提纯方法等为解答的关键,侧重分析与应用及计算能力的考查,综合性较强,题目难度中等.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案| A. | 在晶体中只要有阳离子就一定有阴离子 | |
| B. | .离子晶体中只有离子键没有共价键,分子晶体中只有分子间作用力没有共价键 | |
| C. | .分子晶体中分子间作用力越大,分子越稳定 | |
| D. | .原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
| A. | 不同化学反应的限度都相同 | |
| B. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| C. | 当一个可逆反应在一定条件下达到限度时,反应即停止 | |
| D. | 当一个可逆反应在一定条件下达到限度时,正反应速率与逆反应速率相等 |
| A. | 盐酸的浓度 | B. | 溶液的温度 | C. | Zn颗粒的大小 | D. | 溶液中Cl-的浓度 |
| A. | 0.25mol | B. | 0.5mol | C. | 1mol | D. | 2mol |
| A. | XW4为非极性分子 | |
| B. | Y、Z、W的最高价氧化物的水化物酸性强弱顺序是Y<Z<W | |
| C. | X、Y的最高价氧化物由固态转化为气态时,克服相同的作用力 | |
| D. | XW4、YW4、ZW2分子中的中心原子均为sp3杂化 |
| A. | 用氯化钡溶液可区别SO42-和CO32-离子 | |
| B. | 只能用加入试剂的方法区别(NH4)2 SO4和Fe2(SO4)3溶液 | |
| C. | 用丁达尔效应可区别Fe(OH)3胶体和饱和FeCl3溶液 | |
| D. | 用澄清石灰水可区别Na2CO3溶液和NaHCO3溶液 |
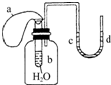
| A. | U形管内红色褪去 | B. | 试管内溶液变红 | C. | 气球a被吹大 | D. | U形管水位d<c |