题目内容
13.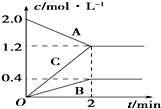 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:(1)该反应的反应物是A.
(2)该反应的化学方程式是2A?B+3C.
(3)2min内,A物质的平均反应速率为0.4mol/(L•min)..
分析 (1)随反应进行,反应物的浓度降低,生成物的浓度增大,据此结合图象判断;
(2)根据浓度变化量之比等于化学计量数之比确定化学计量数,t是达到平衡状态,为可逆反应,据此书写方程式;
(4)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,根据v=$\frac{△c}{△t}$计算A物质的平均反应速率.
解答 解:(1)由图可知,随反应进行A的浓度降低,A为反应物,B、C的浓度增大,故B、C为生成物,故答案为:A;
(2)由图可知,△c(A)=)=2.0mol/L-1.2mol/L=0.8mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为:0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,反应为可逆反应,故反应方程式为:2A?B+3C,
故答案为:2A?B+3C;
(3)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,则v(A)=$\frac{0.8mol/L}{2min}$=0.4mol/(L•min),故答案为:0.4mol/(L•min).
点评 本题考查物质的量浓度随时间变化的曲线、化学反应速率的计算等知识,题目难度中等,试题旨在考查学生对基础知识的掌握情况,根据图象曲线变化正确判断反应物、生成物为解答关键,注意掌握化学反应速率的计算方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列各原子或离子的电子排布式错误的为( )
| A. | Na+ 1s22s22p6 | B. | F- 1s22s22p6 | ||
| C. | N3- 1s22s22p3 | D. | O 1s22s22p4 |
1.下面有关晶体的叙述中,正确的是( )
| A. | 在晶体中只要有阳离子就一定有阴离子 | |
| B. | .离子晶体中只有离子键没有共价键,分子晶体中只有分子间作用力没有共价键 | |
| C. | .分子晶体中分子间作用力越大,分子越稳定 | |
| D. | .原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
8.下列说法中正确的是( )
| A. | 锂离子电池和碱性锌锰干电池都是二次电池 | |
| B. | 燃料电池是一种高效但是会污染环境的新型电池 | |
| C. | 化学电池的反应基础是氧化还原反应 | |
| D. | 铅蓄电池放电的时候正极是Pb,负极是PbO2 |
18.下列物质中既能跟氢氧化钠反应又能跟盐酸反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al.
| A. | ③④ | B. | ②③④ | C. | ①③④ | D. | 全部 |
5.下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
| A. | Na和O2 | B. | NaHCO3和NaOH | C. | NaOH和CO2 | D. | Na2CO3和HCl |
3.短周期元素X、Y、Z和W的原子序数依次增大.X原子的最外层电子数是内层电子数的2倍,Y与X同主族,Z和W原子中未成对电子数之比为2:1.下列说法错误的是( )
| A. | XW4为非极性分子 | |
| B. | Y、Z、W的最高价氧化物的水化物酸性强弱顺序是Y<Z<W | |
| C. | X、Y的最高价氧化物由固态转化为气态时,克服相同的作用力 | |
| D. | XW4、YW4、ZW2分子中的中心原子均为sp3杂化 |