题目内容
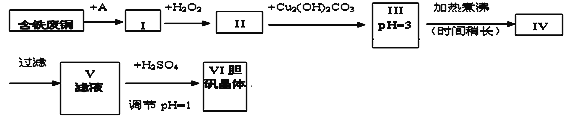
【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
pH值控制可参考下列数据
物 质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A物质可选用_____(填字母)。
a.稀H2SO4 b.浓H2SO4/△ c.浓FeCl3溶液 d.浓HNO3
(2)I中加H2O2的离子方程式________________________________________。
(3)II中加Cu2(OH)2CO3的目的是________________________;其优点是__________。
(4)III加热煮沸时发生的化学反应的离子方程式为________________________。
(5)V中加H2SO4调节pH=1是为了____________________________________________。
(6)V到VI的操作是_________________________________
(7)某同学认为上述流程中所加的A物质并不理想,需作改进,其理由是__________。如何改进___________________。
【答案】b2H+ +H2O2+2Fe2+=2H2O+2Fe3+中和过量的硫酸,调节溶液的pH,使Fe3+水解完全而沉淀不引入新的杂质Fe3++3H2O=Fe(OH)3↓+3H+抑制Cu2+的水解蒸发浓缩,冷却结晶,过滤产生污染环境的二氧化硫,硫酸利用率低加热,并在稀硫酸中通入氧气
【解析】
废铜(主要杂质为Fe)来制备胆矾的流程:将金属全部溶解,再将存在的亚铁离子氧化为铁离子,再结合Cu2+开始沉淀时的pH值,可以Fe最终转化为Fe(OH)3更容易除去,保证铜离子不会沉淀,不能引进杂质离子,加入H2O2,目的是将二价铁转化为三价铁,在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,目的应是调节溶液的酸碱性,所以这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁正全转化为Fe(OH)3.当三价铁沉淀完全后,再进行过滤,滤液中剩余的阳离子主要有Cu2+,阴离子有SO42-,再加硫酸,调节溶液pH值=1,目的是抑制Cu2+的水解,再分别进行蒸发、冷却、结晶后,最终得到产品胆矾.
(1)a、稀硫酸不能溶解Cu,故不选a;b、浓H2SO4、加热条件下可以溶解铜与铁,故选b;c、浓FeCl3溶液可溶解铁和铜,但会引入新的杂质,故c不选;d、浓HNO3可溶解铁和铜,但会引入新的杂质,故d不选;因此,本题正确答案是:b;
(2)H2O2与Fe2+发生氧化还原反应,Fe2+被氧化为Fe3+后,调节pH,更容易除去,所以Ⅰ中加H2O2的目的将亚铁离子氧化为铁离子,离子反应为:2H+ +H2O2+2Fe2+=2H2O+2Fe3+;
(3)在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁正全转化为Fe(OH)3,并且不引入新的杂质;
(4)Ⅲ加热煮沸时,促进铁离子水解,可以得到氢氧化铁沉淀,发生的化学反应的离子方程式为:Fe3++3H2O![]() Fe(OH)3↓+3H+;
Fe(OH)3↓+3H+;
(5)V中加H2SO4调节pH=1是为了抑制Cu2+的水解;
(6)从硫酸铜溶液中获得硫酸铜晶体可以经过蒸发浓缩,冷却结晶,过滤的方法;
(7)Cu与浓硫酸反应过程中会产生SO2,会对污染环境,这样会使硫酸的利用率低,所以可以向稀硫酸中不断通氧气(或者加H2O2)并加热。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)的关系见下表.
m-n | 0 | 1 | 2 | 3 |
含氧酸强度 | 弱酸 | 中强 | 强 | 很强 |
实例 | HClO | H3PO4 | HNO3 | HClO4 |
试回答下列问题:
(1)按此规则判断碳酸应属于_____酸。
(2)按此规则判断H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为_______________。
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大.已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构__________________、________________________。




