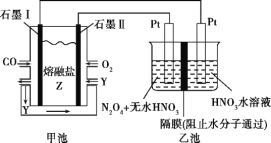
题目内容
【题目】60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)的关系见下表.
m-n | 0 | 1 | 2 | 3 |
含氧酸强度 | 弱酸 | 中强 | 强 | 很强 |
实例 | HClO | H3PO4 | HNO3 | HClO4 |
试回答下列问题:
(1)按此规则判断碳酸应属于_____酸。
(2)按此规则判断H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为_______________。
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大.已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构__________________、________________________。
【答案】 中强酸 H3AsO4<H2CrO4<HMnO4 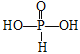
![]()
【解析】(1)碳酸中m-n=1,按此规则碳酸应属于中强酸。
(2)H3AsO4、H2CrO4、HMnO4中的m-n依次为1、2、3,按此规则,依次为中强酸、强酸、很强酸。
(3)H3PO3为中强酸,H3PO3中含1个非羟基氧原子,P原子最外层有5个电子,H3PO3的分子结构为 ;H3AsO3为弱酸,H3AsO3中不含非羟基氧原子,As原子最外层有5个电子,根据价键规则,H3AsO3的分子结构为
;H3AsO3为弱酸,H3AsO3中不含非羟基氧原子,As原子最外层有5个电子,根据价键规则,H3AsO3的分子结构为![]() 。
。
(1)碳酸的分子式为H2CO3,其中m-n=1,按此规则碳酸应属于中强酸。
(2)H3AsO4、H2CrO4、HMnO4中的m-n依次为1、2、3,按此规则,依次为中强酸、强酸、很强酸,酸性由弱到强的顺序为H3AsO4![]() H2CrO4
H2CrO4![]() HMnO4。
HMnO4。
(3)H3PO3为中强酸,H3PO3中含1个非羟基氧原子,P原子最外层有5个电子,H3PO3的分子结构为 ;H3AsO3为弱酸,H3AsO3中不含非羟基氧原子,As原子最外层有5个电子,根据价键规则,H3AsO3的分子结构为
;H3AsO3为弱酸,H3AsO3中不含非羟基氧原子,As原子最外层有5个电子,根据价键规则,H3AsO3的分子结构为![]() 。
。

【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
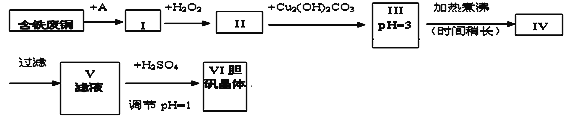
pH值控制可参考下列数据
物 质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A物质可选用_____(填字母)。
a.稀H2SO4 b.浓H2SO4/△ c.浓FeCl3溶液 d.浓HNO3
(2)I中加H2O2的离子方程式________________________________________。
(3)II中加Cu2(OH)2CO3的目的是________________________;其优点是__________。
(4)III加热煮沸时发生的化学反应的离子方程式为________________________。
(5)V中加H2SO4调节pH=1是为了____________________________________________。
(6)V到VI的操作是_________________________________
(7)某同学认为上述流程中所加的A物质并不理想,需作改进,其理由是__________。如何改进___________________。