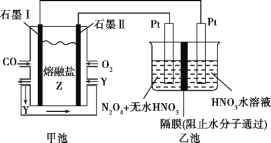
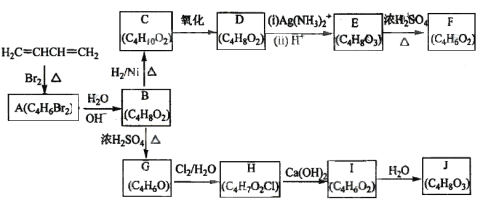
题目内容
【题目】结构决定性质,研究物质的组成、结构对于学习物质的性质至关重要。
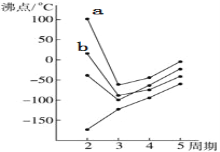
(1)如图中每条折线表示周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点、b点分别代表的是 ___________、___________ (写化学式),a比b的沸点高的原因是__________________________________。
(2)在超高压下,科学家用激光器将CO2加热到1800K,成功制得了类似石英的CO2原子晶体。由此推测该CO2晶体中O—C—O键角为__________,与石英相比该晶体的熔点、沸点________(“更高”或“更低”),理由是_________________________________。
(3)利用铜萃取剂M可通过如下反应实现铜离子的富集:
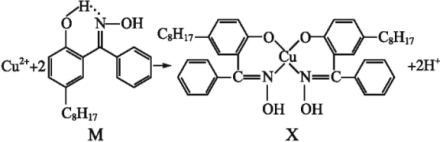
①M所含元素的电负性由大到小顺序为____,其中氮原子以__轨道与氧原子形成σ键。
②M与W(右图)相比,M的水溶性较小,更利于Cu2+的萃取。M水溶性较小的主要原因是___________________________________。
(4)常用![]() 表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为
表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为![]() 。已知吡咯(下图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,请问:吡咯分子中的大π键应表示为________,吡咯分子中N原子的杂化类型为 ________,1mol吡咯分子中所含的σ键数目为________。
。已知吡咯(下图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,请问:吡咯分子中的大π键应表示为________,吡咯分子中N原子的杂化类型为 ________,1mol吡咯分子中所含的σ键数目为________。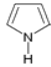
【答案】 H2O HF 水分子间形成的氢键数目较多 10928ˊ 更高 C原子半径较小,C-O键键长较短,键能较大 O>N>C>H sp2杂化 M能形成分子内氢键,使溶解度减小 ![]() sp2 10NA
sp2 10NA
【解析】(1)a点、b点对应是第二周期IVA~VIIA族元素的氢化物,第二周期IVA~VIIA族元素的氢化物依次为CH4、NH3、H2O、HF,NH3、H2O、HF分子间都存在氢键,氢键的强度:NH3分子间氢键![]() H2O分子间氢键
H2O分子间氢键![]() HF分子间氢键,水分子间形成的氢键的数目比HF分子间形成氢键数目多,沸点:CH4
HF分子间氢键,水分子间形成的氢键的数目比HF分子间形成氢键数目多,沸点:CH4![]() NH3
NH3![]() HF
HF![]() H2O(H2O的沸点为100℃),a点代表H2O,b点代表HF。
H2O(H2O的沸点为100℃),a点代表H2O,b点代表HF。
(2)CO2原子晶体类似石英,CO2晶体中O—C—O键角为10928ˊ。与石英相比,该晶体的熔点、沸点更高,因为:C原子半径较小,C-O键键长较短,键能较大。
(3)①M中的元素有C、H、O、N,四种元素电负性由大到小的顺序为O![]() N
N![]() C
C![]() H。M中N原子形成1个C=N键和1个N-O键,N原子上还有1对孤电子对,N原子为sp2杂化。
H。M中N原子形成1个C=N键和1个N-O键,N原子上还有1对孤电子对,N原子为sp2杂化。
②W能与H2O分子间形成氢键,M形成分子内氢键,使溶解度减小。
(4)吡咯分子中的各个原子均在同一平面内,吡咯分子中C和N都采用sp2杂化,每个C原子未参与杂化的2p轨道上有1个电子,N原子的sp2杂化轨道形成1个N-H键和2个N-C键,N原子的未参与杂化的2p轨道上有2个电子,吡咯中形成大π键的原子为4个C原子和1个N原子,形成大π键的电子数为4+2=6个。1个吡咯分子中含10个σ键。
(1)a点、b点对应是第二周期IVA~VIIA族元素的氢化物,第二周期IVA~VIIA族元素的氢化物依次为CH4、NH3、H2O、HF,NH3、H2O、HF分子间都存在氢键,氢键的强度:NH3分子间氢键![]() H2O分子间氢键
H2O分子间氢键![]() HF分子间氢键,水分子间形成的氢键的数目比HF分子间形成氢键数目多,沸点:CH4
HF分子间氢键,水分子间形成的氢键的数目比HF分子间形成氢键数目多,沸点:CH4![]() NH3
NH3![]() HF
HF![]() H2O(H2O的沸点为100℃),a点代表H2O,b点代表HF。H2O比HF沸点高的原因是:水分子间形成的氢键的数目比HF分子间形成氢键数目多。
H2O(H2O的沸点为100℃),a点代表H2O,b点代表HF。H2O比HF沸点高的原因是:水分子间形成的氢键的数目比HF分子间形成氢键数目多。
(2)CO2原晶体类似石英,其中C原子与4个O原子形成4个C—O键,CO2晶体中O—C—O键角为10928ˊ。与石英相比,该晶体的熔点、沸点更高,因为:CO2原子晶体和石英都属于原子晶体,C原子半径较小,C-O键键长较短,键能较大。
(3)①M中的元素有C、H、O、N,非金属性O![]() N
N![]() C
C![]() H,四种元素电负性由大到小的顺序为O
H,四种元素电负性由大到小的顺序为O![]() N
N![]() C
C![]() H。M中N原子形成1个C=N键和1个N-O键,N原子上还有1对孤电子对,N原子为sp2杂化,N原子以sp2杂化轨道与氧原子形成σ键。
H。M中N原子形成1个C=N键和1个N-O键,N原子上还有1对孤电子对,N原子为sp2杂化,N原子以sp2杂化轨道与氧原子形成σ键。
② W能与H2O分子间形成氢键,M形成分子内氢键,使溶解度减小,M的水溶性更小。
(4)吡咯分子中的各个原子均在同一平面内,吡咯分子中C和N都采用sp2杂化,每个C原子未参与杂化的2p轨道上有1个电子,N原子的sp2杂化轨道形成1个N-H键和2个N-C键,N原子的未参与杂化的2p轨道上有2个电子,吡咯中形成大π键的原子为4个C原子和1个N原子,形成大π键的电子数为4+2=6个,吡咯中的大π键应表示为![]() ,吡咯分子中N原子为sp2杂化。1个吡咯分子中含10个σ键(3个碳碳σ键、2个碳氮σ键、4个碳氢σ键和1个氮氢σ键),1mol吡咯分子中所含σ键为10NA。
,吡咯分子中N原子为sp2杂化。1个吡咯分子中含10个σ键(3个碳碳σ键、2个碳氮σ键、4个碳氢σ键和1个氮氢σ键),1mol吡咯分子中所含σ键为10NA。

 阅读快车系列答案
阅读快车系列答案【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
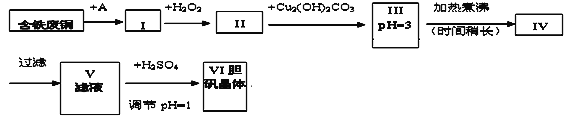
pH值控制可参考下列数据
物 质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A物质可选用_____(填字母)。
a.稀H2SO4 b.浓H2SO4/△ c.浓FeCl3溶液 d.浓HNO3
(2)I中加H2O2的离子方程式________________________________________。
(3)II中加Cu2(OH)2CO3的目的是________________________;其优点是__________。
(4)III加热煮沸时发生的化学反应的离子方程式为________________________。
(5)V中加H2SO4调节pH=1是为了____________________________________________。
(6)V到VI的操作是_________________________________
(7)某同学认为上述流程中所加的A物质并不理想,需作改进,其理由是__________。如何改进___________________。