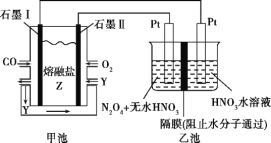
题目内容
【题目】A、B、C、D、E、F、G的原子序数依次增大的元素,A、D元素的原子最外层电子数相同,A元素的一种原子没有中子;B的一种同位素可用于考古断代;C是地壳中含量最多的一种元素;D元素的阳离子电子层结构与氖原子相同;E的最外层电子数是电子层数的2倍;F的单质具有强氧化性.G是用途最广泛的金属元素,它的单质能被磁铁所吸引;试回答以下问题:
(1)E的原子结构示意图:____________。
(2)D单质与C单质在加热条件下反应产物的电子式 _______,该物质与A2C反应的离子方程式______。
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性.则甲、乙反应的化学方程式为____________。
(4)E的最高价氧化物对应水合物的浓溶液加入G单质,下列说法正确的是____________。
A.常温下两者不发生反应 B.常温下无现象 ,G单质不溶解
C.受热能发生反应,开始放出氢气 D. 受热能发生反应,开始放出是SO2
(5)用电子式写出A2C的形成过程___________________________________________________。
【答案】
![]() 2Na2O2+2H2O=4Na++4OH-+O2↑ NaHCO3+NaOH=Na2CO3+H2O BD
2Na2O2+2H2O=4Na++4OH-+O2↑ NaHCO3+NaOH=Na2CO3+H2O BD ![]()
【解析】
A、B、C、D、E、F、G的原子序数依次增大的元素,A元素的一种原子没有中子,则A为H元素;B的一种同位素可用于考古断代,则B为C元素;C是地壳中含量最多的一种元素,则C为O元素;A、D元素的原子最外层电子数相同,D元素的阳离子电子层结构与氖原子相同,则D为Na元素;E的最外层电子数是电子层数的2倍,则E为S元素;F的单质具有强氧化性,则F为Cl元素;G是用途最广泛的金属元素,它的单质能被磁铁所吸引,则G为Fe元素;据此答题。
由分析可知:A为H元素,B为C元素,C为O元素,D为Na元素,E为S元素,F为Cl元素,G为Fe元素。
(1)S为16号元素,有3个电子层,最外层有6个电子,原子结构示意图为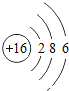 ,故答案为:
,故答案为: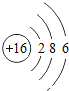 。
。
(2)钠在加热条件下与氧气反应生成过氧化钠,过氧化钠是由钠离子与过氧根离子通过离子键结合而成的离子化合物,电子式为![]() ,过氧化钠与水反应生成氢氧化钠和氧气,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:
,过氧化钠与水反应生成氢氧化钠和氧气,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:![]() ,2Na2O2+2H2O=4Na++4OH-+O2↑。
,2Na2O2+2H2O=4Na++4OH-+O2↑。
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性,符合条件的甲、乙两物质为碳酸氢钠和氢氧化钠,反应的化学方程式为NaHCO3+NaOH=Na2CO3+H2O,故答案为:NaHCO3+NaOH=Na2CO3+H2O。
(4)S的最高价氧化物对应水合物的浓溶液为浓H2SO4,浓硫酸具有很强的氧化性,铁的表面会生成一层致密的氧化物薄膜,发生钝化现象,铁和冷的浓硫酸发生钝化,是发生了化学反应;浓硫酸具有很强的氧化性,因此铁和浓硫酸在加热的条件下反应开始放出的气体是SO2,随着反应的进行,硫酸的浓度变小,才可能有氢气放出,所以BD正确,故答案为BD。
(5)H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为![]() ,故答案为:
,故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
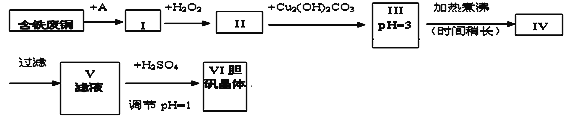
pH值控制可参考下列数据
物 质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A物质可选用_____(填字母)。
a.稀H2SO4 b.浓H2SO4/△ c.浓FeCl3溶液 d.浓HNO3
(2)I中加H2O2的离子方程式________________________________________。
(3)II中加Cu2(OH)2CO3的目的是________________________;其优点是__________。
(4)III加热煮沸时发生的化学反应的离子方程式为________________________。
(5)V中加H2SO4调节pH=1是为了____________________________________________。
(6)V到VI的操作是_________________________________
(7)某同学认为上述流程中所加的A物质并不理想,需作改进,其理由是__________。如何改进___________________。