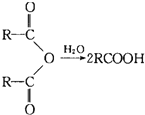
题目内容
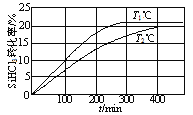
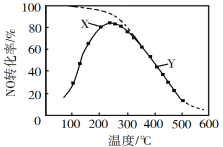
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A.反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间不能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
【答案】D
【解析】
A.随温度升高,反应相同的时间,NO的转化率先升高后降低,说明温度较低时反应较慢,这段时间内并未达到平衡,分析温度较高时,已达到平衡时的NO转化率可知,温度越高NO转化率越低,说明温度升高平衡向逆方向移动,根据勒夏特列原理分析该反应为放热反应,H<0,A错误;
B.根据上述分析,X点时,反应还未到达平衡状态,反应正向进行,所以延长反应时间能提高NO的转化率,B错误;
C.Y点,反应已经达到平衡状态,此时增加O2的浓度,使得正反应速率大于逆反应速率,平衡向正反应方向移动,可以提高NO的转化率,C错误;
D.设NO起始浓度为a mol/L,NO的转化率为50%,则平衡时NO、O2和NO2的浓度分别为0.5amol/L、(5×10-4-0.25a)mol/L、0.5a mol/L,根据平衡常数表达式K=![]() >2000,D正确;
>2000,D正确;
答案为D。

练习册系列答案
相关题目