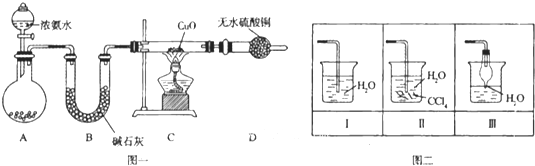
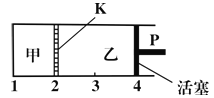
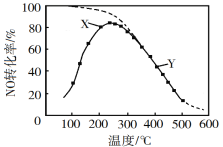
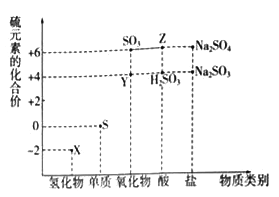
��Ŀ����
����Ŀ����֪����Ԫ�ص�ԭ�������Ĵ�С˳��ΪC>A>B>D>E��A��Cͬ���ڣ�B��Cͬ���壻A��B�γ����ӻ����A2B���������ӵĵ�������ͬ�����������Ϊ30��D��E���γ�4��10���ӵķ��ӡ��Իش��������⣺
��1��д��������Ԫ�ص����ơ�A___��B__��C__��D___��E__��
��2��д��DԪ�ص��ʵĽṹʽ��___��
��3��д���������ʵĵ���ʽ��
E��B�γɵĻ����__��A��B��E�γɵĻ����__��D��E�γɵĻ����___��
��4��A��B��Ԫ����ɵĻ�����A2B2����___(��������������������)��������ڵĻ�ѧ����___��д��A2B2��ˮ��Ӧ�Ļ�ѧ����ʽ��__��
���𰸡��� �� �� �� �� N��N ![]() ��
��![]()
![]()
![]() ���� ���Ӽ����ۼ� 2Na2O2��2H2O=4NaOH��O2��
���� ���Ӽ����ۼ� 2Na2O2��2H2O=4NaOH��O2��
��������
A��B�γ����ӻ����A2B���������ӵĵ�������ͬ�����������Ϊ30����ȷ��A��B�γ����Ӿ�Ϊ10����������A����Ϊ+1�ۣ�B����Ϊ-2�ۣ���AΪNa��BΪO��B��Cͬ���壬��CΪS��D��E���γ�4��10���ӵķ��ӣ�����Ϊ��������DΪN��EΪH��
(1)������֪��AΪ�ƣ�BΪ����CΪ��DΪ����EΪ�⣻
(2)DԪ�صĵ���Ϊ���������ڹ��۷��ӣ���ṹʽΪN��N��
(3)E��B�γɵĻ�����Ϊˮ��������⣬����ʽΪ![]() ��
��![]() ��A��B��E�γɵĻ�����ΪNaOH������ʽΪ
��A��B��E�γɵĻ�����ΪNaOH������ʽΪ![]() ��D��E�γɵĻ�����Ϊ����������ʽΪ
��D��E�γɵĻ�����Ϊ����������ʽΪ![]() ��
��
(4)A��B��Ԫ����ɵĻ�����A2B2Ϊ�������ƣ��������ӻ����Na��O��������Ӽ���O��O����ڷǼ��Թ��ۼ�������������ˮ��Ӧ�����������ƺ�����������ʽΪ2Na2O2��2H2O=4NaOH��O2����

 ��У����ϵ�д�
��У����ϵ�д�