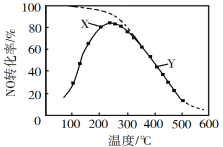
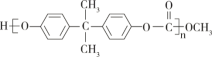
��Ŀ����
����Ŀ�������[NH4Al(SO4)2��12H2O]�Ƿ�����ѧ���õĻ��Լ�����ҵ�ϳ���������(��Ҫ�ɷ�ΪAl2O3)�����������������Z��ˮ��Һ�������˿��������乤������ͼ���£�
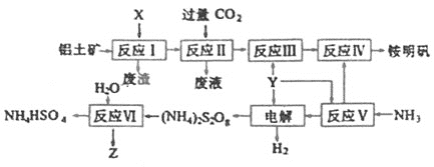
��1��д����Ӧ������ӷ���ʽ________��
��2���ӷ�ӦIV���������Һ�л������������ʵ���������Ϊ________��________�����ˡ�ϴ��(���������)��
��3����Ӧ���Ļ�ѧ����ʽΪ________��
��4����ˮ�к���Fe2+��Mn2+�Ƚ������Ӷ���Ȼ���������ص��ƻ����ã�����(NH4)2S2O8������ȥ��д��Mn2+����������MnO2�����ӷ���ʽΪ________��ZҲ�н�ǿ�����ԣ���ʵ�������в���Z����Mn2+��ԭ����________��
���𰸡�AlO2-+CO2+2H2O=Al(OH)3��+HCO3- ����Ũ�� ��ȴ�ᾧ (NH4)2S2O8+2H2O=2NH4HSO4+H2O2 S2O82-+2H2O+Mn2+=4H++2SO42-+MnO2�� �̵Ļ�����ɴ�H2O2�ķֽ⣬ʹ���ĵ�H2O2����
��������
��1����Ӧ���Լ�XΪ����Һ���������е�Al2O3��Ӧ�γ�AlO2������˷�Ӧ����ͨ�������CO2����Ӧ����Al(OH)3������HCO3����
��2�����������Һ�л�����������IJ���Ϊ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ�
��3����Ӧ���з�Ӧ��Ϊ(NH4)2S2O8��H2O��������ΪNH4HSO4��H2O2��
��4�����ݻ��ϼ���������ƽ��MnO2�ܴ�H2O2�ķֽ⡣
��1����Ӧ�������Լ�XΪ����Һ���������е�Al2O3��Ӧ�γ�AlO2������˷�Ӧ����ͨ�������CO2����Ӧ����Al(OH)3������HCO3�����÷�Ӧ�����ӷ���ʽΪ��AlO2����CO2��2H2O=Al(OH)3����HCO3����
��2�����������Һ�л�����������IJ���Ϊ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ�
��3����ͼʾ���̿�֪����Ӧ���з�Ӧ��Ϊ(NH4)2S2O8��H2O��������ΪNH4HSO4��Z������Z���������ԣ�ͬʱ���������ԭ���ɿɵã�ZΪH2O2����˸÷�Ӧ�Ļ�ѧ����ʽΪ��(NH4)2S2O8+2H2O=2NH4HSO4+H2O2��
��4��Mn2������������MnO2�Ĺ����У�S2O82������ԭΪSO42������������Ԫ���ɣ�2�۱�Ϊ��4�ۣ�ʧȥ2�����ӣ���Ԫ���ɣ�7�۱�Ϊ��6�ۣ��õ��������ӣ����ݵ�ʧ�����غ�ɵã�Mn2����MnO2��S2O82����ϵ����Ϊ1��SO42����ϵ��Ϊ2�����ݵ���غ�ɵã��������к���H������ϵ��Ϊ4��������ԭ�Ӹ����غ�ɵã���Ӧ������H2O������ϵ��Ϊ2����˿ɵø÷�Ӧ�����ӷ���ʽΪ��S2O82-+2H2O+Mn2+=4H++2SO42-+MnO2����
������������֪��ZΪH2O2�� MnO2�ܴ�H2O2�ķֽ⣬��˲���Z����Mn2����

 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�����Ŀ���±���ijͬѧ̽��Na2SO3��Һ��(VI)����Һ��Ӧ���ɵ�ʵ���¼����֪��Cr2O72-(��ɫ)+ H2O![]() 2CrO42-(��ɫ)+ 2H+
2CrO42-(��ɫ)+ 2H+
��� | a | b | ���� | |
| 1 | 2 mL 0.05 mol��L1 K2Cr2O7��Һ(pH = 2) | 3�α���Na2SO3��Һ(pH = 9) | ��Һ����ɫ(��Cr3+) |
2 | 2 mL 0.1 mol��L1 K2CrO4��Һ(pH = 8) | 3�α���Na2SO3��Һ | ��Һû�����Ա仯 | |
3 | 2 mL����Na2SO3��Һ | 3��0.05 mol��L1 K2Cr2O7��Һ | ��Һ���ɫ | |
4 | 2 mL����ˮ | 3��0.05 mol��L1 K2Cr2O7��Һ | ��Һ���dz��ɫ |
����˵������ȷ����
A. ʵ��1�е���ɫ��Һ�к���SO42-
B. ʵ��1��2��a��Һ������������������ͬ
C. ��ʵ��3��Һ�м����μӹ��������ʹ��Һ��Ϊdz��ɫ
D. ʵ��4��Ŀ�����ų�ϡ�Ͷ���Һ��ɫ�仯��ɵ�Ӱ��