题目内容
【题目】向体积均为2 L的两个恒容密闭容器中分别充入1mol SiHCl3,维持容器的温度分别为T1℃和T2℃不变,发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH1=a kJ·mol1。反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
SiH2Cl2(g)+SiCl4(g) ΔH1=a kJ·mol1。反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
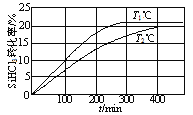
A.T1<T2
B.T1℃时,0~100min反应的平均速率υ(SiHCl3)=0.001mol·(L·min)-1
C.T2℃时,反应的平衡常数:K=1/64
D.T2℃时,使用合适的催化剂,可使SiHCl3的平衡转化率与T1℃时相同
【答案】C
【解析】
A.“先拐先平数值大”,升高温度,化学反应速率会增大,达到平衡的时间会缩短,图中可看出T1>T2,A错误;
B.T1℃时,0~100min SiHCl3的转化率为10%,反应的平均速率υ(SiHCl3)=0.0005mol·(L·min)-1,B错误;
C.从图中信息可以看出,T2℃时达到平衡SiHCl3的转化率为20%,则:
2SiHCl3(g) SiH2Cl2(g)+SiCl4(g)
起始量 0.5 0 0
转化量 0.1 0.05 0.05
平衡量 0.4 0.05 0.05
则平衡常数K=1/64,C正确;
D.催化剂不会使平衡移动,不会改变SiHCl3的平衡转化率,D错误;
答案为C。

练习册系列答案
相关题目