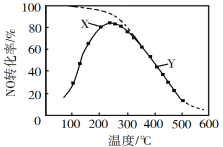
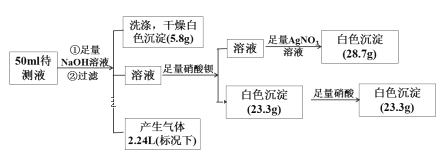
题目内容
【题目】I.实验室配制90mL 1 mol·L-1的NaOH溶液:
(1)用托盘天平称量NaOH的质量为________g。
(2)配制该溶液时需用的主要仪器有烧杯、玻璃棒、胶头滴管、_______________等。
(3)误差下列情况使配制结果偏大的是________。
A.溶解后未冷却即转移、定容
B.定容时仰视容量瓶刻度线
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切
D.托盘天平砝码生锈
E.容量瓶内残有少量蒸馏水
Ⅱ. 某同学学习了铁及其化合物的性质,欲设计实验研究铁及其化合物的部分性质。
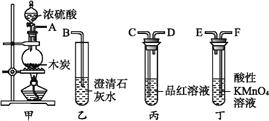
(1)该同学根据下图装置做相关实验,请回答下列问题:
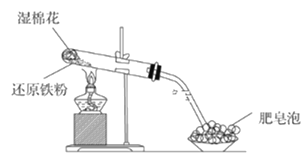
①硬质试管中发生反应的化学方程式为_______________。
②该同学将硬质试管冷却后的少量固体物质溶于稀盐酸得溶液A,向溶液A中滴加KSCN溶液,若溶液未变红色,原因是:________________(用离子方程式表示)。
③该同学向溶液A中滴入一定量的氯水,用该所得溶液腐蚀刻铜板制电路板的主要反应离子方程式___________。
(2)该同学用如下图所示装置制取Fe(OH)2,实验时使用铁屑、6 mol/L硫酸,其他试剂任选。回答下列问题:
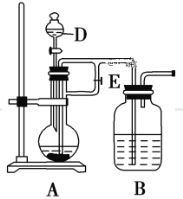
向仪器D中需要放入硫酸,装置B中盛有一定量的NaOH溶液,A中盛有铁屑,实验开始时应先将活塞E打开,待装置中空气排尽后,将活塞E关闭,一段时间后能够长时间观察到装置B中的白色沉淀原因是_____;待A中停止反应后,观察到装置B的白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,写出B中出现该现象的反应方程式______。
【答案】4.0 100mL容量瓶 AD 3Fe+4H2O(g)![]() Fe3O4+4H2 Fe+2Fe3+= 3Fe2+ Cu+2Fe3+=Cu2++2Fe2+ Fe与盐酸反应生成了氢气,隔绝了空气 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
Fe3O4+4H2 Fe+2Fe3+= 3Fe2+ Cu+2Fe3+=Cu2++2Fe2+ Fe与盐酸反应生成了氢气,隔绝了空气 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
【解析】
I.(1)实验室没有90 mL的容量瓶,配制90mL 1 mol·L-1的NaOH溶液应选用100mL容量瓶;
(2)用托盘天平称量4.0g NaOH后,配制该溶液的实验步骤为溶解、转移、洗涤、定容、振荡、装瓶,需用的主要仪器有烧杯、玻璃棒、胶头滴管、100mL容量瓶;
(3)依据溶质的物质的量和溶液的体积是否变化分析判断;
Ⅱ.(1)①硬质试管中还原铁粉高温下与水蒸气反应生成四氧化三铁和氢气;
②若还原铁粉过量,将硬质试管冷却后的少量固体物质溶于稀盐酸后,四氧化三铁溶于盐酸生成氯化铁和氯化亚铁,还原铁粉与反应生成的氯化铁恰好反应生成氯化亚铁,向溶液中滴加KSCN溶液,溶液不会变红色;
③向氯化亚铁溶液中滴入一定量的氯水,氯气将氯化亚铁氧化为氯化铁,氯化铁溶液与铜反应生成氯化亚铁和氯化铜;
(3)实验开始时应先将活塞E打开,铁和稀硫酸反应生成硫酸亚铁和氢气,生成的氢气进入整套实验装置中而排出空气,防止氢氧化亚铁被氧化;关闭活塞E,在气体压强的作用下,A中含有硫酸亚铁溶液被压人B中,硫酸亚铁和氢氧化钠溶液反应,生成Fe(OH)2白色沉淀;氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀,所以待A中停止反应后,空气中氧气将Fe(OH)2氧化,观察到白色沉淀先转化为灰绿色最后转化为红褐色。
I.(1)实验室没有90 mL的容量瓶,配制90mL 1 mol·L-1的NaOH溶液应选用100mL容量瓶,氢氧化钠的物质的量为1 molL-1×0.1L=0.1mol,NaOH的质量为0.1mol×40g/mol=4.0g,则用托盘天平称量NaOH的质量为4.0g,故答案为:4.0;
(2) 用托盘天平称量4.0g NaOH后,配制该溶液的实验步骤为溶解、转移、洗涤、定容、振荡、装瓶,需用的主要仪器有烧杯、玻璃棒、胶头滴管、100mL容量瓶,故答案为:100mL容量瓶;
(3)A、溶解后未冷却即转移、定容,溶液体积会偏小,导致所配溶液浓度偏大,故正确;
B、定容时仰视容量瓶刻度线,导致溶液体积偏大,所配溶液浓度偏小,故错误;
C、用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切,会导致溶质的物质的量偏小,所配溶液浓度偏小,故错误;
D、托盘天平砝码生锈,会导致所测氢氧化钠的质量偏大,所配溶液浓度偏大,故正确;
E、由稀释定律可知,容量瓶内残有少量蒸馏水,对氢氧化钠的物质的量没有影响,对所配溶液浓度无影响,故错误;
AD正确,故答案为:AD;
Ⅱ.(1)①硬质试管中还原铁粉高温下与水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
②若还原铁粉过量,将硬质试管冷却后的少量固体物质溶于稀盐酸后,四氧化三铁溶于盐酸生成氯化铁和氯化亚铁,还原铁粉与反应生成的氯化铁恰好反应生成氯化亚铁,向溶液中滴加KSCN溶液,溶液不会变红色,还原铁粉与反应生成的氯化铁恰好反应生成氯化亚铁的离子方程式为Fe+2Fe3+= 3Fe2+,故答案为:Fe+2Fe3+= 3Fe2+;
③向氯化亚铁溶液中滴入一定量的氯水,氯气将氯化亚铁氧化为氯化铁,氯化铁溶液与铜反应生成氯化亚铁和氯化铜,则氯化铁溶液腐蚀刻铜板制电路板的主要反应离子方程式为Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(3)实验开始时应先将活塞E打开,铁和稀硫酸反应生成硫酸亚铁和氢气,生成的氢气进入整套实验装置中而排出空气,防止氢氧化亚铁被氧化;关闭活塞E,在气体压强的作用下,A中含有硫酸亚铁溶液被压人B中,硫酸亚铁和氢氧化钠溶液反应,生成Fe(OH)2白色沉淀;氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀,所以待A中停止反应后,空气中氧气将Fe(OH)2氧化,观察到白色沉淀先转化为灰绿色最后转化为红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:Fe与盐酸反应生成了氢气,隔绝了空气;4Fe(OH)2+O2+2H2O=4Fe(OH)3。

【题目】下表是某同学探究Na2SO3溶液和铬(VI)盐溶液反应规律的实验记录,已知:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+
2CrO42-(黄色)+ 2H+
序号 | a | b | 现象 | |
| 1 | 2 mL 0.05 mol·L1 K2Cr2O7溶液(pH = 2) | 3滴饱和Na2SO3溶液(pH = 9) | 溶液变绿色(含Cr3+) |
2 | 2 mL 0.1 mol·L1 K2CrO4溶液(pH = 8) | 3滴饱和Na2SO3溶液 | 溶液没有明显变化 | |
3 | 2 mL饱和Na2SO3溶液 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变黄色 | |
4 | 2 mL蒸馏水 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变成浅橙色 |
下列说法不正确的是
A. 实验1中的绿色溶液中含有SO42-
B. 实验1、2的a溶液中所含的离子种类相同
C. 向实验3溶液中继续滴加过量硫酸可使溶液变为浅橙色
D. 实验4的目的是排除稀释对溶液颜色变化造成的影响