题目内容
3.根据表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )| 元素代号 | A | B | C | D | E |
| 原子半径 | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6,-2 | -2 |
| A. | 金属性:C>A | B. | 氢化物的稳定性:H2D<H2E | ||
| C. | 单质与稀盐酸反应的速率:A<B | D. | 单质的熔点:A>B>E |
分析 短周期元素,由元素的化合价可知,D、E都有-2价,而D有+6价且原子半径较大,则D为元素、E为O元素;A、B、C化合价分别为+1、+3、+2,则分别处于IA族、ⅢA族、ⅡA族,C的原子半径小于硫,故C为Be元素,原子半径A、B均大于硫,则B为Al,且A、B原子半径相差较大,故A为Na,结合元素周期律解答.
解答 解:短周期元素,由元素的化合价可知,D、E都有-2价,而D有+6价且原子半径较大,则D为元素、E为O元素;A、B、C化合价分别为+1、+3、+2,则分别处于IA族、ⅢA族、ⅡA族,C的原子半径小于硫,故C为Be元素,原子半径A、B均大于硫,则B为Al,且A、B原子半径相差较大,故A为Na.
A.同周期自左而右金属性减弱、同主族自上而下金属性增强,故金属性Na>Be,故A错误;
B.非金属性S<O,则气态氢化物的稳定性H2S<H2O,故B正确;
C.金属性Na比Al强,则Na与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为A>B,故C错误;
D.氧气为气体,钠、铝为固体,氧气熔点最低,钠离子半径大于铝离子,且钠离子所带正电荷比铝离子少,故金属铝的金属键更强,熔点高于Na,故D错误,
故选:B.
点评 本题考查结构性质位置关系应用,关键是根据化合价与原子半径推断元素,注意D选项中熔沸点高低比较.

练习册系列答案
相关题目
13.下列实验不能达到相应的实验目的是( )
| 选项 | 实验 | 实验目的 |
| A | 钠和镁分别投入冷水中 | 判断钠和镁金属性强弱 |
| B | 在MgCl2与AlCl3溶液中分别加入过量的氨水 | 判断镁与铝的金属性强弱 |
| C | 向硅酸钠溶液中通入CO2 | 判断碳酸与硅酸的酸性强弱 |
| D | Br2与I2分别与足量的H2反应 | 判断溴与碘的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
14.下列说法正确的是( )
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 | |
| B. | 月桂烯 (  )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 取卤代烃,加入氢氧化钠的乙醇溶液加热一段时间后冷却,再加入稀硝酸酸化的硝酸银溶液,一定会产生沉淀,并根据沉淀颜色判断卤代烃中卤原子的种类 | |
| D. | 通常条件下,1mol的  分别与H2 和浓溴水完全反应时,消耗的H2和 分别与H2 和浓溴水完全反应时,消耗的H2和Br2的物质的量分别是 4mol、3mol |
8.下列说法正确的是( )
①非极性分子中一定含有非极性键;
②S-Sσ键与s-pσ键的电子云形状相同;
③含有π键的化合物与只含σ键的化合物的化学性质不同;
④中心原子采取sp3杂化的分子,其立体构型不一定是正四面体
⑤氢键不仅存在于分子之间,有时也存在于分子内
⑥3p2表示3p能级有两个轨道.
①非极性分子中一定含有非极性键;
②S-Sσ键与s-pσ键的电子云形状相同;
③含有π键的化合物与只含σ键的化合物的化学性质不同;
④中心原子采取sp3杂化的分子,其立体构型不一定是正四面体
⑤氢键不仅存在于分子之间,有时也存在于分子内
⑥3p2表示3p能级有两个轨道.
| A. | ③④⑤ | B. | ①②③④⑤ | C. | ②③④ | D. | ②③④⑤⑥ |
16.8g硫与0.2mol氧气充分反应后的气体总体积在标准状况下为( )
| A. | 1.12 L | B. | 2.24 L | C. | 3.36 L | D. | 4.48 L |
 ;
;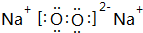 .
.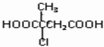 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:(RCH3CH=CH2+HCl$\stackrel{催化剂}{→}$RCH3CHClCH3)
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:(RCH3CH=CH2+HCl$\stackrel{催化剂}{→}$RCH3CHClCH3)  实验室制取乙烯的装置如下图所示,请回答:
实验室制取乙烯的装置如下图所示,请回答: