题目内容
15. 实验室制取乙烯的装置如下图所示,请回答:
实验室制取乙烯的装置如下图所示,请回答:(1)反应中浓硫酸起催化剂和脱水剂的作用.
(2)加热前应该在烧瓶内放入少量碎瓷片,它的作用是防止暴沸
(3)温度计的作用是控制反应温度.
(4)该实验可能产生的主要的有机副产物是乙醚.
(5)制取乙烯的反应类型是消去反应,反应的化学方程式是:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
分析 (1)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂;
(2)因乙醇的沸点低,易暴沸,所以加入碎瓷片作沸石,防暴沸;
(3)该反应的温度为170℃,需用温度计控制;
(4)乙醇在浓硫酸催化、脱水条件下加热到140度能够反应生成乙醚;
(5)实验室利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯.
解答 解:(1)乙醇在浓硫酸做催化剂、脱水剂作用下加热到170度,发生消去反应生成乙烯,
故答案为:催化;脱水;
(2)乙醇的沸点低,易暴沸,加碎瓷片可以防止暴沸,
故答案为:防止暴沸;
(3)该反应条件为迅速升高温度到170度,所以需要用温度计控制反应温度,
故答案为:控制反应温度;
(4)乙醇在浓硫酸催化、脱水条件下加热到140度能够反应生成乙醚,2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O,所以产生乙醚副产物,
故答案为:乙醚;
(5)乙醇在浓硫酸做催化剂、脱水剂作用下加热到170度,发生消去反应生成乙烯,方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:消去反应;CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
点评 本题考查了实验室制备乙烯,明确反应原理是解题关键,注意反应的条件及浓硫酸的作用,题目难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
6.某主族元素R的最高正化合价与负化合价代数和为6,下列叙述正确的是( )
| A. | R的最高价氧化物为RO3 | B. | R一定是第ⅦA族元素 | ||
| C. | R的气态氢化物能燃烧 | D. | R的气态氢化物易溶于水显碱性 |
3.根据表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径 | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6,-2 | -2 |
| A. | 金属性:C>A | B. | 氢化物的稳定性:H2D<H2E | ||
| C. | 单质与稀盐酸反应的速率:A<B | D. | 单质的熔点:A>B>E |
10.两种短周期元素组成的化合物中,原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系中可能是( )
①a=b+5 ②a+b=30 ③a+b=8 ④a-b=8.
①a=b+5 ②a+b=30 ③a+b=8 ④a-b=8.
| A. | ②③ | B. | ②③④ | C. | ①②③④ | D. | ③④ |
20.下列有机物不能通过乙烯的加成反应制取的是( )
| A. | CH3CH2Cl | B. | CH2Cl-CH2Cl | C. | CH3-CH2OH | D. | CH3-COOH |
8.下列措施或事实不能用勒沙特列原理解释的是( )
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | H2、I2、HI平衡混合气加压后颜色变深 | |
| C. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 | |
| D. | 合成氨反应常采用2×107~5×107Pa |
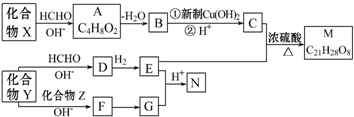
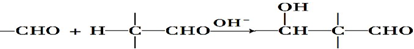
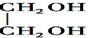 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$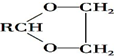 +H2O
+H2O
 .
.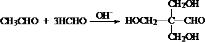 .
.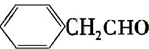
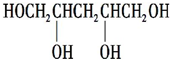 .
.