题目内容
13.下列实验不能达到相应的实验目的是( )| 选项 | 实验 | 实验目的 |
| A | 钠和镁分别投入冷水中 | 判断钠和镁金属性强弱 |
| B | 在MgCl2与AlCl3溶液中分别加入过量的氨水 | 判断镁与铝的金属性强弱 |
| C | 向硅酸钠溶液中通入CO2 | 判断碳酸与硅酸的酸性强弱 |
| D | Br2与I2分别与足量的H2反应 | 判断溴与碘的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.金属的金属性越强,金属单质与水或酸反应越剧烈;
B.金属的金属性越强,其最高价氧化物的水化物碱性越强;
C.强酸和弱酸盐反应生成弱酸;
D.元素的非金属性越强,其单质与氢气反应越容易.
解答 解:A.金属的金属性越强,金属单质与水或酸反应越剧烈,钠和镁分别投入冷水中,钠和水剧烈反应、镁和冷水不反应,所以可以判断钠、镁的金属性强弱,故A不选;
B.金属的金属性越强,其最高价氧化物的水化物碱性越强,氯化镁和氯化铝溶液分别和氨水混合都生成白色沉淀,不能鉴别氢氧化镁、氢氧化铝碱性强弱,所以不能判断镁、铝的金属性强弱,故B选;
C.强酸和弱酸盐反应生成弱酸,碳酸钠和二氧化碳、水反应生成难溶性的硅酸,说明碳酸酸性大于硅酸,故C不选;
D.元素的非金属性越强,其单质与氢气反应越容易,溴和氢气需要加热生成HBr,碘和氢气需要不断加热生成HI,所以可以根据溴、碘分别与氢气反应条件判断非金属性强弱,故D不选;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及非金属性、金属性强弱判断及酸性强弱判断,明确物质的性质是解本题关键,知道金属性、非金属性强弱判断方法,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
3.下列的判断或说法不正确的是( )
| A. | 溶解少量食盐于水中:△S>0 | |
| B. | 自发一定是放热反应 | |
| C. | 自发反应一定是熵增加或者放热反应 | |
| D. | CaCO3 (S) 分解成CaO (S) 和 CO2(g):△S>0 |
4.有机物分子中基团之间的相互影响会导致物质化学性质的不同.下列事实能说明上述观点的是 ( )
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 苯在50℃~60℃时发生硝化反应,而甲苯在30℃时即可 |
1.下列解释事实的方程式不准确的是( )
| A. | 铝热法炼铁:Fe2O3+2Al$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+2Fe | |
| B. | 工业上用NH3制备NO:4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O | |
| C. | 向受酸雨影响的湖泊中喷洒CaCO3粉末:CO32-+2H+$\frac{\underline{\;催化剂\;}}{\;}$H2O+CO2↑ | |
| D. | 过氧化钠用于呼吸面具中作为氧气的2Na2O2+2CO2═2Na2CO3+O2 |
18. 某氢氧燃料电池的原理如图所示.该电池的负极反应式为:H2-2e-═2H+.则下列判断中错误的是( )
某氢氧燃料电池的原理如图所示.该电池的负极反应式为:H2-2e-═2H+.则下列判断中错误的是( )
 某氢氧燃料电池的原理如图所示.该电池的负极反应式为:H2-2e-═2H+.则下列判断中错误的是( )
某氢氧燃料电池的原理如图所示.该电池的负极反应式为:H2-2e-═2H+.则下列判断中错误的是( )| A. | a处通入的是H2 | B. | 电解质溶液可能是NaOH溶液 | ||
| C. | 电极X是负极,被氧化 | D. | Y极的反应为O2+4e-+4H+═2H2O |
3.根据表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径 | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6,-2 | -2 |
| A. | 金属性:C>A | B. | 氢化物的稳定性:H2D<H2E | ||
| C. | 单质与稀盐酸反应的速率:A<B | D. | 单质的熔点:A>B>E |
 ,而不排布成
,而不排布成 ,其直接的根据是洪特规则.
,其直接的根据是洪特规则.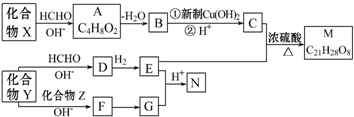
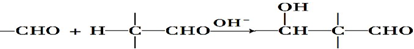
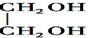 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$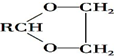 +H2O
+H2O
 .
.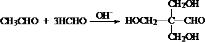 .
.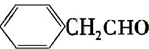
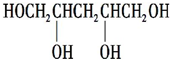 .
.
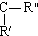 $\stackrel{KMnO4/H+}{→}$RCOOH+
$\stackrel{KMnO4/H+}{→}$RCOOH+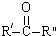
 +H2O
+H2O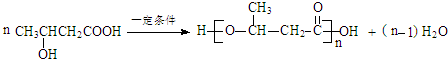 .
. .
.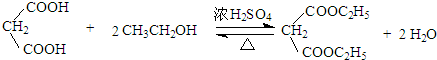 .
.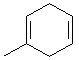 .
.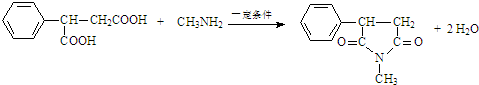 .
.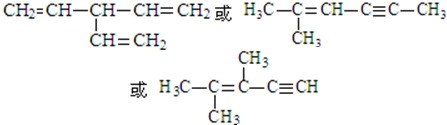 (写出一种即可).
(写出一种即可).