题目内容
17.已知:H-H、N-H、N≡N的键能分别为436KJ/mol,391KJ/mol,946KJ/mol,则:1molH2(g)与足量氮气完全反应生成NH3(g)的反应热△H(KJ/mol)为( )| A. | +30.67 | B. | -345.3 | C. | -30.67 | D. | +345.3 |
分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,反应热=吸收的总能量-放出的总能量.
解答 解:反应热=化学键断裂吸收的总能量-化学键形成放出的总能量,所以1mol N2生成NH3的反应热=946kJ+3×436 kJ-2×3×391kJ=-92kJ,所以是放出热量;
1mol H2生成NH3的反应热=$\frac{1}{3}$×946kJ+436kJ-$\frac{2}{3}$×3×391kJ=-30.67kJ,所以是放出热量.
故选C.
点评 本题考查反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
相关题目
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
2.下列物质性质与应用对应关系正确的是( )
| A. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| B. | 钠具有很强的还原性,可用钠与TiCl4反应制取钛 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | 铜的金属活泼性比铁强,可用于保护石油管道(碳素钢管)以减缓其腐蚀 |
9.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.现进行如图所示实验.下列有关说法正确的是( )
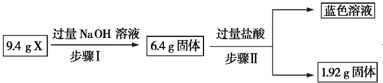

| A. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
6.下列有关说法正确的是( )
| A. | 为减小酸碱中和滴定的实验误差,锥形瓶必须洗净、烘干后使用 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 | |
| D. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知100 mL 0.1 mol•L-1 的盐酸与100 mL 0.1 mol•L-1 的氨水混合,放出的热量等于0.573 kJ |
15.下列电离方程式中,正确的是( )
| A. | Al2(SO4)3=2Al+3+3SO4-2 | B. | K2SO4=2K++S6++4O2- | ||
| C. | CuCl2=Cu2++2Cl- | D. | Na2CO3=Na++CO32- |
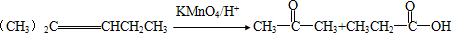

 ;D
;D
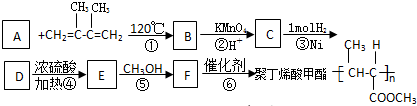
 )是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图:
)是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图: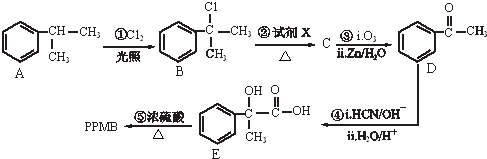
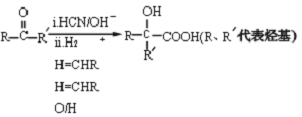
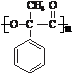 .
. .
. 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”).
,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”). ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.