题目内容
11.磷及其化合物在科研及生产中均有着重要的应用.(1)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下.
2P(s)+3Cl2(g)=2PCl3(g)△H=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g)△H=-798kJ/mol
气态 PCl5生成气态PCl3和Cl2的热化学方程式为PCl5(g)?PCl3(g)+Cl2(g)△H=+93kJ•mol-1.
(2)可逆反应PCl3(g)+Cl2(g)?PCl5(g) 2E(g)?F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板.反应开始和达到平衡时有关物理量变化如图1所示:
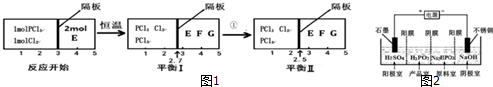
①达到平衡Ⅰ时,体系压强与反应开始时体系压强之比为20:23.
②平衡I到平衡Ⅱ的条件①是降温(填“升温”或“降温”)..
(3)亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3,电解Na2HPO3溶液也可得到亚磷酸,装置如图2所示:阴极的电极反应式为2H++2e-=H2↑;产品室中反应的离子方程式为HPO32-+2H+=H3PO3.
(4)在一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26向浓度均为0.20mol•L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO3,先生成Mg3(PO4)2沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c=10-4mol/L.
分析 (1)由①2P(s)+3Cl2(g)=2PCl3(g)△H=-612kJ/mol
②2P(s)+5Cl2(g)=2PCl5(g)△H=-798kJ/mol
则根据盖斯定律$\frac{①-②}{2}$得热化学方程式;
(2)①根据右室的混合物总物质的量不变,在同温同压下体积比等于物质的量之比计算出反应后(I)中混合气体的物质的量,再计算出达平衡(I)时体系的压强与反应开始时体系的压强之比;
②根据平衡I到平衡Ⅱ,左边气体物质的量在变小,结合反应为放热反应判断;
(3)阴极上得电子发生还原反应;产品室中HPO32-和氢离子结合 生成亚磷酸;
(4)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Mg3(PO4)2先生成沉淀,当溶液中C(Mg2+)=10-5 mol/L时,认为镁离子完全沉淀,再根据磷酸根浓度计算c(Ca2+).
解答 解:(1)由①2P(s)+3Cl2(g)=2PCl3(g)△H=-612kJ/mol
②2P(s)+5Cl2(g)=2PCl5(g)△H=-798kJ/mol
则$\frac{①-②}{2}$得反应的热化学方程式为PCl5(g)?PCl3(g)+Cl2(g)△H=$\frac{-612kJ/mol+798kJ/mol}{2}$=+93kJ•mol-1,
故答案为:PCl5(g)?PCl3(g)+Cl2(g)△H=+93kJ•mol-1;
(2)①右室的混合物总物质的量不变为2mol,左右两室的压强、温度相等,同温同压下,体积之比等于物质的量之比,平衡(I)中左室混合气体总的物质的量为$\frac{2.7}{2.3}$×2mol=$\frac{54}{23}$mol,反应过程中温度不变,根据PV=nRT可知:P=$\frac{n}{V}$RT,所以达平衡(I)时体系的压强与反应开始时体系的压强之比为$\frac{\frac{54}{23}}{2.7}$:$\frac{3}{3}$=20:23,
故答案为:20:23;
②又可逆反应PCl3(g)+Cl2(g)?PCl5(g)为放热反应,根据平衡I到平衡Ⅱ,左边气体物质的量在变小,所以平衡向正反应方向移动,故为降温,故答案为:降温;
(3)阴极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑;产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3;
故答案为:2H++2e-=H2↑;HPO32-+2H+=H3PO3;
(4)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Mg3(PO4)2先生成沉淀,当溶液中C(Mg2+)=10-5 mol/L时,认为镁离子完全沉淀,则溶液中的磷酸根浓度为C2(PO43-)=$\frac{Ksp[Mg{\;}_{3}(PO{\;}_{4}){\;}_{2}]}{c(Mg{\;}^{2+}){\;}^{3}}$=$\frac{6.0×10{\;}^{-29}}{(10{\;}^{-5}){\;}^{3}}$=6.0×10-14,所以c(Ca2+)=$\root{3}{\frac{6.0×10{\;}^{-26}}{6.0×10{\;}^{-14}}}$=10-4.故答案为:Mg3(PO4)2;10-4.
点评 本题考查了盖斯定律的应用、平衡移动原理、电解原理的应用以及难溶物的溶解平衡等知识点,根据难溶物的溶解特点、溶度积常数中各个物理量之间的关系计算,综合性较强,难度较大.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| A. | Y形成的简单离子半径小于Z形成的简单离子半径 | |
| B. | X的氢化物稳定性弱于Y的氢化物稳定性 | |
| C. | 四种元素中,W的氧化物对应的水合物酸性最强 | |
| D. | Y与Z形成的两种化合物中所含有化学键类型相同 |
| A. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| B. | 钠具有很强的还原性,可用钠与TiCl4反应制取钛 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | 铜的金属活泼性比铁强,可用于保护石油管道(碳素钢管)以减缓其腐蚀 |
| A. | 按系统命名法,有机物 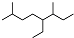 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | 谷氨酸分子(α-氨基戊二酸)缩合只能形成1种二肽(不考虑立体异构) | |
| D. | 在一定条件下,1.0 mol的  最多能与含3.0 mol NaOH的溶液完全反应 最多能与含3.0 mol NaOH的溶液完全反应 |
| A. | 为减小酸碱中和滴定的实验误差,锥形瓶必须洗净、烘干后使用 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 | |
| D. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知100 mL 0.1 mol•L-1 的盐酸与100 mL 0.1 mol•L-1 的氨水混合,放出的热量等于0.573 kJ |

| A. | 含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热 | |
| B. | 途径②增大O2浓度可提高SO2转化率 | |
| C. | 途径②中SO2和SO3均属于酸性氧化物 | |
| D. | 若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1)+O2 (g)为放热反应 |
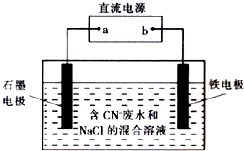 工业上,在强碱性条件下用电解法除去废水中的CN-,装置如右图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装置如右图所示,依次发生的反应有:①CN--2e-+2OH-═CNO-+H2O
②2Cl-一2e-═Cl2↑
③3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O
下列说法正确的是( )
| A. | 除去1 mol CN-,外电路至少需转移5 mol电子 | |
| B. | 通电过程中溶液的pH不断增大 | |
| C. | 为了使电解池连续工作,需要不断补充NaCl | |
| D. | 铁电极上发生的反应为Fe一2e一═Fe2+ |
| A. | XO${\;}_{3}^{2-}$ | B. | ZO${\;}_{4}^{2-}$ | C. | YO${\;}_{2}^{-}$ | D. | WO- |