题目内容
【题目】某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:
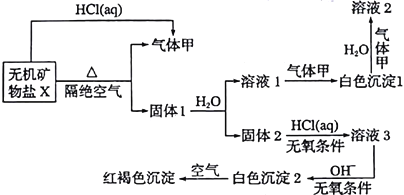
另取21.6gX在惰性气流中加热至完全分解,得到12.8g固体1和0.2mol气体甲。
(1)画出白色沉淀1中金属元素的原子结构示意图_____________,写出气体甲的电子式_______。
(2)X的化学式是______________,在惰性气流中加热X至完全分解的化学反应方程式为______________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个有气体生成的可能的化学反应方程式______________________________,并设计实验方案验证该反应的产物___________________________________________。
【答案】 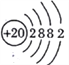
![]() CaFe(CO3)2 CaFe(CO3)2
CaFe(CO3)2 CaFe(CO3)2![]() CaO+FeO+2CO2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2FeO+CO2===Fe2O3+CO 检验Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色表明产物中有Fe3+;检测CO:将气体通过灼热CuO,黑色固体变为红色
CaO+FeO+2CO2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2FeO+CO2===Fe2O3+CO 检验Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色表明产物中有Fe3+;检测CO:将气体通过灼热CuO,黑色固体变为红色
【解析】①根据已知信息:21.6gX→12.8g固体1+0.2mo甲,质量守恒,所以0.2mol甲的质量为(21.6g-12.8g)=8.8g,则气体的摩尔质量为:8.8g÷0.2mol=44g/mol。所以气体甲为CO2;
②红褐色沉淀为Fe(OH)3,逆推,白色沉淀2为Fe(OH)2,溶液3为FeCl2,固体2为FeO;所以X中含有Fe元素。③隔绝空气加热X得到CO2和固体1,且X和HCl(aq)反应也能得到CO2,则X为弱酸盐,且X含有C、O元素;弱酸盐分解得到固体,则推测固体1为金属氧化物;固体1溶于水得到溶液1和固体2,溶液1和CO2反应生成白色沉淀1,白色沉淀1和CO2、H2O反应生成溶液2,则白色沉淀1为碳酸盐、溶液2为碳酸氢盐;X为无机矿物盐,可推测白色沉淀1为碳酸钙,即固体1种含有CaO。则X中四种元素分别为:Fe、Ca、C、O。
固体1成分为CaO、FeO,21.6gX在惰性气流中加热至完全分解,得到12.8g固体1和0.2molCO2, 0.1molFeO 和0.1molCaO质量恰好为12.8g,可推测X化学式为:CaO·FeO·2CO2,CaFe(CO3)2。
(1)白色沉淀1是CaCO3,碳酸钙中金属元素的原子核外有4个电子层、最外层有2个电子,所以Ca原子结构示意图为 ,气体甲是CO2, CO2的电子式为
,气体甲是CO2, CO2的电子式为![]() ;
;
故答案为: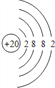 ;
;![]() ;
;
(2)X的化学式是CaFe(CO3)2,在惰性气流中加热X至完全分解生成CO2和CaO、FeO。故反应方程式为CaFe(CO3)2![]() CaO+FeO+2CO2↑;
CaO+FeO+2CO2↑;
(3)氢氧化亚铁不稳定,易被空气氧化生成红褐色氢氧化铁,所以白色沉淀2在空气中变成红褐色沉淀,反应方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3;
(4)FeO具有还原性,能被CO2氧化生成Fe2O3,同时生成CO,反应方程式为:2FeO+CO2=Fe2O3+CO。检验如果该反应发生,则生成固体中含有三价铁,将固体溶于稀盐酸生成铁离子,可通过加入KSCN溶液检验铁离子的存在。将气体通过灼热CuO,若黑色固体变为红色,则说明有CO的生成。
故答案为:2FeO+CO2===Fe2O3+CO;检验Fe2O3,将固体用稀盐酸溶解,加入KSCN溶液若显红色表明产物中有Fe3+;检测CO,将气体通过灼热CuO,黑色固体变为红色。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】请回答下列问题.
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度. 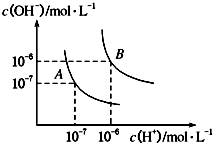
①100℃时1molL﹣1的NaOH溶液中,由水电离出的c(H+)=molL﹣1 , KW(25℃)KW(100℃)(填“>”、“<”或“=”).
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”).
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
【题目】高纯晶体硅是信息技术的关键材料。
(1)硅元素位于周期表的__________周期_________族。下面有关硅材料的说法中正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰
E. 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(2)工业上用石英砂和焦炭可制得粗硅。
已知:

请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g) △H=_____________
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:________________________________,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷。
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅。
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,可用_________________方法提纯SiHCl3。
物质 | SiHCl3 | SiCl4 | AsCl3 |
沸点/℃ | 32.0 | 57.5 | 131.6 |
②用SiHCl3制备高纯硅的反应为SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是_____________________(填字母序号)。
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是_____________________(填字母序号)。
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是![]()
C.实际生产中为提高SiHCl3的利用率,应适当升高温度
③整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HC1和另一种物质,写出配平的化学反应方程式:____________________________________。
【题目】下列实验操作能达到实验目的的是
选项 | 实验操作 | 实验目的 |
A | 向盛有2mL0.1mo/LAgNO3溶液的试管中滴加一定量0.1mo/LNaCl溶液,再向其中滴加一定量0.1mol/LKI溶液 | 证明相同温度下的溶度积常数Ksp(AgCl)>Ksp(AgI) |
B | 取两支试管,分别加入4mL0.01mol/LKMnO4酸性溶液,然后向一支试管中加入0.1mol/LH2C2O4液2mL,向另一支试管中加入0.1mol/L H2C2O4液4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越大 |
C | 向盛有1mL浓硫酸的试管中加入5mL0.01mol/LK2Cr2O7溶液 | 证明增大生成物的浓度,使平衡Cr2O72-(橙色)+H2O |
D | 向混有BaCO3沉淀的NaOH溶液中满入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中的NaOH含量 |
A. A B. B C. C D. D