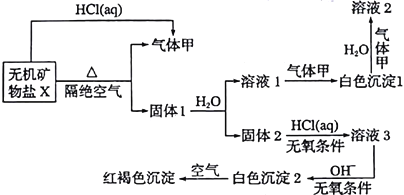
题目内容
【题目】表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.试回答下列问题: 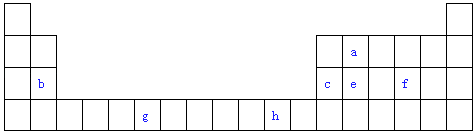
(1)写出元素g的基态原子电子排布式 .
(2)f在空气中燃烧产物的分子构型为 , 中心原子的杂化形式为 , 该分子是(选填“极性”、“非极性”)分子.
(3)由a原子跟e原子以1:1相互交替结合而形成的晶体,晶型与晶体e相同.两者相比熔点更高的是(填化学式),试从结构角度加以解释 .
(4)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 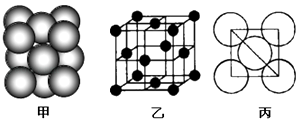
若已知c的原子半径为d厘米,NA代表阿伏伽德罗常数,c的相对原子质量为M,请回答:
①晶胞中c原子的配位数为 , 表示原子空间占有率的代数式为 .
②该晶体的密度为g/cm3(用含有关字母的代数式表示),b、h中,与c单质晶体中原子的堆积方式相同的是(填元素符号).
【答案】
(1)[Ar]3d54s1或1s22s22p63s23p63d54s1
(2)角型(或V字型);sp2杂化;极性分子
(3)SiC;二者同为原子晶体,键长:C﹣Si键<Si﹣Si键,C﹣Si键更牢固
(4)12;![]() ;
;![]() ;Cu
;Cu
【解析】解:(1)g为Cr元素,为24号元素,原子核外有24个电子,所以核外电子排布式为:[Ar]3d54s1或1s22s22p63s23p63d54s1 , 所以答案是:[Ar]3d54s1或1s22s22p63s23p63d54s1;(2)S元素,在空气中燃烧生成SO2 , S有1对孤对电子,存在S=O键,价层电子对个数=σ键个数+孤电子对个数,SO2的价层电子对个数=2+ ![]() (6﹣2×2)=3,S原子采取sp2杂化,为角型(或V字型),正负电荷中心不重合,为极性分子,
(6﹣2×2)=3,S原子采取sp2杂化,为角型(或V字型),正负电荷中心不重合,为极性分子,
所以答案是:角型(或V字型),sp2杂化,极性分子;(3)由C原子跟Si原子以1:1相互交替结合而形成的SiC 晶体,晶型与晶体Si相同.均为原子晶体,但Si﹣C键键长<Si﹣Si键长,则Si﹣C键能大,C﹣Si键更牢固,SiC的熔点高,
所以答案是:SiC;二者同为原子晶体,键长:C﹣Si键<Si﹣Si键,C﹣Si键更牢固;(4)①根据图片知,Al单质为面心立方最密堆积,Al原子配位数=3× ![]() ×8=12,铝 的原子半径为d厘米,晶胞的边长为4dcm×
×8=12,铝 的原子半径为d厘米,晶胞的边长为4dcm× ![]() =2
=2 ![]() dcm,每个铝晶胞中含有4个原子,则铝原子总体积为4×
dcm,每个铝晶胞中含有4个原子,则铝原子总体积为4× ![]() πd3cm3 , 晶胞体积为(2
πd3cm3 , 晶胞体积为(2 ![]() dcm)3 , 故空间利用率为
dcm)3 , 故空间利用率为 ![]() =
= ![]() ,
,
所以答案是: ![]() ;②铝原子个数=8×
;②铝原子个数=8× ![]() +6×
+6× ![]() =4,相对原子质量为M,故晶胞的质量=4×
=4,相对原子质量为M,故晶胞的质量=4× ![]() g,每个铝晶胞中含有4个原子,正方形对角线长度为4d cm,故立方体的棱长为:
g,每个铝晶胞中含有4个原子,正方形对角线长度为4d cm,故立方体的棱长为: ![]() ×4dcm=2
×4dcm=2 ![]() d cm,晶胞体积为(2
d cm,晶胞体积为(2 ![]() dcm)3=16
dcm)3=16 ![]() d3cm3 , 故晶体的密度ρ=
d3cm3 , 故晶体的密度ρ= ![]() =
= ![]() =
= ![]() ,立方最密堆积,属于镁、锌、钛型,面心立方最密堆积(Cu型),所以与c单质晶体中原子的堆积方式相同的是Cu,
,立方最密堆积,属于镁、锌、钛型,面心立方最密堆积(Cu型),所以与c单质晶体中原子的堆积方式相同的是Cu,
所以答案是: ![]() ;Cu.
;Cu.

【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:① 2Fe3++H2O2 == 2Fe2++O2↑+2H+,② H2O2+2Fe2++2H+ == 2H2O+2Fe3+。反应过程中能量变化如下图所示。下列说法错误的是
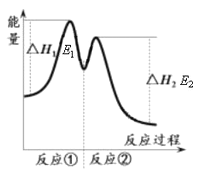
A. Fe3+的作用是增大过氧化氢的分解速率
B. 反应①是吸热反应、反应②是放热反应
C. 反应2H2O2(aq) == 2H2O(l)+O2(g)的ΔH=E1-E2<0
D. 0~6 min的平均反应速率:v(H2O2)=3.33×10-2 mol·L-1·min-1