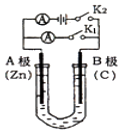
题目内容
【题目】用质量分数为98%的浓硫酸(ρ=l.84g·cm-3)配制240mLl.84mol.L-1稀硫酸,下列操作正确的是 ( )
A. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B. 必需的定量仪器有100mL量筒、250mL容量瓶和托盘天平
C. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
D. 量取浓硫酸的体积为25.0mL
【答案】D
【解析】配制![]() 稀硫酸需要用
稀硫酸需要用![]() 容量瓶,浓硫酸的浓度为98%×l.84×1000/98=18.4mol/L,设浓硫酸的体积为VL,根据稀释前后溶质的量不变:18.4×V=0.25×l.84,V=0.025L=25 mL,所以量取浓硫酸的体积为25.0 mL,D正确;由于量取浓硫酸的体积为
容量瓶,浓硫酸的浓度为98%×l.84×1000/98=18.4mol/L,设浓硫酸的体积为VL,根据稀释前后溶质的量不变:18.4×V=0.25×l.84,V=0.025L=25 mL,所以量取浓硫酸的体积为25.0 mL,D正确;由于量取浓硫酸的体积为![]() ,故只需
,故只需![]() 的量筒,B错误;稀释浓硫酸时应该将浓硫酸缓慢注入一定量蒸馏水中,并不断搅拌至冷却,A错误;容量瓶不能用来稀释浓硫酸,C错误;正确选项D。
的量筒,B错误;稀释浓硫酸时应该将浓硫酸缓慢注入一定量蒸馏水中,并不断搅拌至冷却,A错误;容量瓶不能用来稀释浓硫酸,C错误;正确选项D。

【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(molL﹣1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A﹣)>c(OH﹣)>c(H+)
B.实验①反应后的溶液中:c(OH﹣)=c(K+)﹣c(A﹣)= ![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A﹣)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A﹣)>c(OH﹣)=c(H+)
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:① 2Fe3++H2O2 == 2Fe2++O2↑+2H+,② H2O2+2Fe2++2H+ == 2H2O+2Fe3+。反应过程中能量变化如下图所示。下列说法错误的是
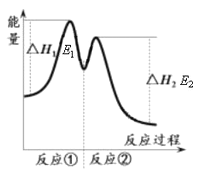
A. Fe3+的作用是增大过氧化氢的分解速率
B. 反应①是吸热反应、反应②是放热反应
C. 反应2H2O2(aq) == 2H2O(l)+O2(g)的ΔH=E1-E2<0
D. 0~6 min的平均反应速率:v(H2O2)=3.33×10-2 mol·L-1·min-1