题目内容
18.在某温度时,测得0.01mol•L-1的NaOH溶液的pH为11.(1)该温度下水的离子积常数KW=1×10-13.
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b 的硫酸Vb L混合.
①若所得混合液为中性,且a=12,b=2,则Va:Vb=1:10;
②若所得混合液为中性,且a+b=11,则Va:Vb=100:1.
(3)pH=11的NaOH溶液与pH=2的CH3COOH溶液等体积混合,所得溶液显酸性.
分析 (1)0.01mol/L的NaOH溶液的pH为11,则c(H+)=1×10-11mol/L,c(OH-)=0.01mol/L,根据Kw=c(H+)×c(OH-)计算;
(2)混合溶液呈中性,且硫酸和氢氧化钠都是强电解质,所以酸中氢离子物质的量和碱中氢氧根离子的物质的量相等;
(3)pH=11的NaOH和pH=2的CH3COOH反应醋酸过量,溶液呈酸性.
解答 解:(1)0.01mol/L的NaOH溶液的pH为11,则c(H+)=1×10-11mol/L,c(OH-)=0.01mol/L,Kw=c(H+)×c(OH-)=1×10-13,故答案为:1×10-13;
(2)①混合溶液呈中性,且硫酸和氢氧化钠都是强电解质,所以酸中氢离子物质的量和碱中氢氧根离子的物质的量相等,pH=a的NaOH溶液中氢氧根离子浓度=10 a-13 mol/L,pH=b的H2SO4溶液氢离子浓度=10-b mol/L,10 a-13 mol/L×VaL=10-b mol/L×VbL,且a=12,b=2,则Va:Vb=1:10,故答案为:1:10;
②10 a-13 mol/L×VaL=10-b mol/L×VbL,且a+b=11,则Va:Vb=100:1,故答案为:100:1;
(3)pH=11的NaOH和pH=2的CH3COOH反应醋酸过量,溶液呈酸性,故答案为:酸.
点评 本题考查酸碱混合的计算,明确该温度下的Kw及pH与浓度的换算是解答本题的关键,注意酸碱反应的实质即可解答,题目难度中等.

练习册系列答案
相关题目
8.下列判断不正确的是( )
| A. | 在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 | |
| B. | 向0.1mol•L-1Na2CO3溶液中加入少量NaOH固体,c(CO32-)与c(Na+)的增大 | |
| C. | NaOH和CH3COONa的混合溶液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 常温下,$\frac{{K}_{W}}{c{(H}^{+})}$=0.1mol•L-1 的溶液中,Na+、K+、CO32-、NO3-、离子可大量共存 |
9.X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体.W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等.下列说法正确的是( )
| A. | 最高价氧化物对应水化物的碱性:Y>W | |
| B. | 气态氢化物的稳定性:X<Z | |
| C. | 原子半径:Y<Z | |
| D. | Y最高价氧化物能与W的最高价氧化物的水化物的溶液反应 |
6.下列叙述正确的是( )
| A. | 离子化合物中一定含有金属元素 | |
| B. | 金属元素不可能存在于阴离子中 | |
| C. | 含有非极性键的化合物不一定是共价化合物 | |
| D. | 由两种元素构成的共价化合物分子中的化学键都是极性键 |
13.现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
| A. | 加入10mL 0.01mol•L-1的NaOH溶液 | B. | 加入10mL 0.01mol•L-1的盐酸溶液 | ||
| C. | 加水稀释成100mL | D. | 加入10mL 的水进行稀释 |
3.一定条件下将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.下列关于该反应的说法错误的是( )
| A. | 增大N2浓度可以增大反应速率 | |
| B. | 增大H2浓度可以使N2转化率达到100% | |
| C. | 升高温度可以加快反应速率 | |
| D. | 高压条件可以加快反应速率 |
10.已知元素的电负性、电离能和原子半径等内容一样,也是元素的一种基本性质,
(1)下面给出14种元素的电负性:
试结合元素周期律知识完成下列问题:
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化,同主族元素从上至下,电负性逐渐同主族元素从上至下电负性减小.
②预测元素电负性的大小关系:Br>I,
电负性最小的元素在周期表中的位置是第6周期ⅠA族 (放射性元素除外).
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物.(电负性Sr=0.95I=2.66Ba=0.89S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是共价键.
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量:
①通过上述信息和表中的数据分析为什么锂原子失去核外第2个电子时所需的能量要远远大于失去第1个电子所需的能量Li原子失去1个电子后形成稳定结构,此时再失去1个电子很困难.
②表中X Y为第3周期元素,则X为Na,Y为Al.第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是Ar.(均填元素符号)
(1)下面给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化,同主族元素从上至下,电负性逐渐同主族元素从上至下电负性减小.
②预测元素电负性的大小关系:Br>I,
电负性最小的元素在周期表中的位置是第6周期ⅠA族 (放射性元素除外).
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物.(电负性Sr=0.95I=2.66Ba=0.89S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是共价键.
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量:
| 锂 | X | Y | |
| 失去第1个电子 | 519 | 502 | 580 |
| 失去第2个电子 | 7296 | 4570 | 1820 |
| 失去第3个电子 | 11799 | 6920 | 2750 |
| 失去第4个电子 | 9550 | 11600 |
②表中X Y为第3周期元素,则X为Na,Y为Al.第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是Ar.(均填元素符号)
8.下列化学用语正确的是( )
| A. | 三氟化氮的电子式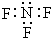 | B. | 水合氢离子电子式: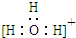 | ||
| C. | 氟离子的结构示意图: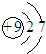 | D. | 中子数为18的硫原子${\;}_{16}^{34}$S |
