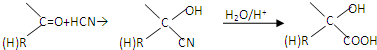
题目内容
13.现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )| A. | 加入10mL 0.01mol•L-1的NaOH溶液 | B. | 加入10mL 0.01mol•L-1的盐酸溶液 | ||
| C. | 加水稀释成100mL | D. | 加入10mL 的水进行稀释 |
分析 常温下pH=1的某强酸溶液中c(H+)=0.1mol/L,使溶液的pH变成2,即c(H+)=0.01mol/L,可加水稀释或加入一定量的碱进行中和,使c(H+)=0.01mol/L即可.
解答 解:常温下pH=1的某强酸溶液中c(H+)=0.1mol/L,使溶液的pH变成2,即c(H+)=0.01mol/L,则:
A、pH=1的某强酸溶液10mL,n(H+)=0.01L×0.1mol/L=0.001mol,10mL0.01mol/L的NaOH溶液,n(OH-)=0.01L×0.01mol/L=0.0001mol,混合后c(H+)=$\frac{0.01mol-0.001mol}{0.02L}$≠0.01mol/L,故A错误;
B、加入10mL0.01mol/L的盐酸,混合后,c(H+)=$\frac{0.01mol+0.01L×0.01mol/L}{0.02L}$≠0.01mol/L,故B错误;
C、加水稀释成100mL,c(H+)=$\frac{0.001mol}{0.1L}$=0.01mol/L,故C正确;
D、加入10mL的水进行稀释,混合后c(H+)=$\frac{0.001mol}{0.02L}$=0.05mol/L≠0.01mol/L,故D错误;
故选C.
点评 本题考查酸碱混合的计算和判断,题目难度中等,注意首先判断混合后溶液的酸碱性,根据溶液混合后c(H+)计算pH值.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
4.下列关于元素性质的有关叙述中不正确的是( )
| A. | C、N、O、F的原子半径依次减小 | |
| B. | Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | C、N、O、F的最高正价依次升高 | |
| D. | Na、Mg、Al、Si的最外层电子数依次增加 |
1.下列元素中,不属于主族元素的是( )
| A. | 钡 | B. | 铁 | C. | 钙 | D. | 碘 |
8.可逆反应H2(g)+I2(g)?2HI(g)在密闭容器中反应,达到平衡状态时的标志是( )
| A. | 混合气体的密度不再改变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的压强不再改变 | |
| D. | I2、H2在混合气体中的体积分数相等 |
5.用NA表示伏伽德罗常数的值,下列说法正确的是( )
| A. | 12 g14C中含有的中子数是8NA | |
| B. | 28g氮气含有的原子数是2NA | |
| C. | 1mol铁与足量稀硝酸完全反应,失去的电子数3NA | |
| D. | 标准状况下,4.48 L NO和2.24 L O2混合气体中含分子总数为0.3NA |
 +CH3Br$\stackrel{催化剂}{→}$
+CH3Br$\stackrel{催化剂}{→}$ +HBr
+HBr
 .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 +
+
 .
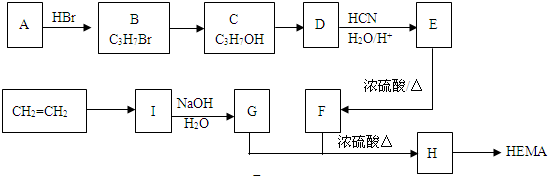
.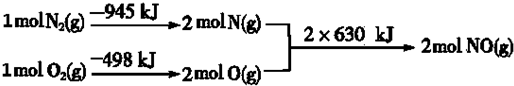
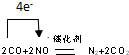 .
.